
8. 将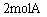 和1molB混合装入容积可变的密闭容器中,发生反应:
和1molB混合装入容积可变的密闭容器中,发生反应:
2A(固)+bB(气) cC(气)
cC(气)
达到化学平衡后,C的物质的量浓度为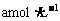 。若在温度一定的条件下,将密闭容器容积变为原来的
。若在温度一定的条件下,将密闭容器容积变为原来的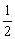 后,C的物质的量浓度为
后,C的物质的量浓度为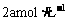 ,且始终不变。则b、c关系是
,且始终不变。则b、c关系是
A. 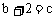 B.
B.
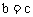
C.  D.
D.
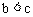
7. 下列离子方程式中正确的是
A. 向苯酚钠溶液中通入少量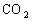 :
: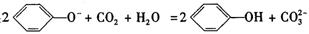
B. 氨水中加入明矾溶液: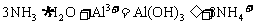
C. 石墨做电极,电解硫酸铜溶液:
D. 氯气溶于水: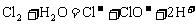
6. “钴酞菁”分子(直径约为1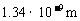 )结构和性质与人体内的血红素及植物内的叶绿素非常相似。下列关于“钴酞菁”分子的说法中正确的是
)结构和性质与人体内的血红素及植物内的叶绿素非常相似。下列关于“钴酞菁”分子的说法中正确的是
A. “钴酞菁”分子在水中所形成的分散系属悬浊液
B. “钴酞菁”分子既能透过滤纸,也能透过半透膜
C. 在分散系中,“钴酞菁”分子的直径比Na+的直径小
D. “钴酞菁”分子在水中形成的分散系能产生丁达尔现象
5. 下列有关安全问题的叙述不正确的是
A. 室内使用煤炉取暖时,为防止煤气中毒应确保煤充分燃烧和烟道通畅
B. 氯气泄露时,应用蘸有肥皂水的湿毛巾捂住口鼻疏散到安全区域
C. 家中发生天然气泄露时,应立即使用室内电话报警
D. 家中做卫生保洁时,严禁漂白粉与浓盐酸混合使用,否则会产生有毒气体
2007.5
本试卷分第I卷(选择题)和第II卷(非选择题)两部分,第I卷1至4页,第II卷5至16页,共300分。考试时间150分钟。
第I卷(选择题,共120分)
本卷共20小题,每小题6分,共120分。在每小题列出的四个选项中,选出符合题目要求的一项。
可能用到的相对原子质量:H 1; C 12; N 14; O 16; Fe 56
28.(14分)1991年美国的B,M,Trost首次提出了化学反应的原子经济性的概念。原子经济性可以用原子利用率来衡量。
原子利用率(%)=
KOH是一种重要的化工原料,广泛应用于KMnO4、K2CO3的生产。
(1)某同学用KOH、CO2为原料,以提高原子利用率为原则,在实验室制取K2CO3固体。所设计的两套方案分别为:
①方案一:
先配制KOH溶液,然后通过过量CO2,再经过蒸发结晶、灼烧得到K2CO3固体。在蒸发结晶过程中用玻璃棒搅拌的目的是
。
②方案二:
第一步骤为:配制KOH溶液并将其等分于两烧杯中。
第二步骤作为:向其中一烧杯中通入 ,反应的化学方程式为 。
将两溶液混合,再经蒸发结晶、灼烧便可得到K2CO3固体。
③试从原子经济性的角度评价上述实验方案。
。
(2)工业上利用KOH和MnO2为原料制取KMnO4。主要生产过程分两步进行:
第一步将MnO2和固体KOH粉碎,混合均匀,在空气中加热之熔化,并连续搅拌以制取K2MnO4;第二步为电解K2MnO4的浓溶液制取KMnO4。
①第一步反应的化学方程式为 。
②电解K2MnO4的浓溶液时,电解池中阴极的实验现象为 。
③用KOH、MnO2等为原料制取K2MnO4过程中的原子利用率为 。
27.(16分)完成以胆矾为原料制取氧化铜固体实验,并用氧化铜和氯酸钾的混合物制氧气,测量生成氧气的体积。试回答:
(1)向CuSO4溶液中滴加NaOH溶液至不再产生沉淀,反应的离子方程式为
。
(2)将溶液和沉淀放入蒸发皿中加热,直至沉淀全部变黑,冷却后过滤。过滤时由于操作失误,造成滤液浑浊,但滤纸尚未破损。造成滤液浑浊的原因可能是 。
(3)某同学设计了如图所示的装置,用于测量氯酸钾催化作用下分解生成氧气的体积。
①用氧化桶和氯酸钾的混合物制氧气的化学方程式为 。
②检查装置气密性后,将CuO和KClO3的混合物平铺在试管底部,将量筒装满水倒扣在水槽中。后续操作的正确顺序是(用下列操作中的部分或全部步骤代号回答)
。a.用酒精灯给试管中的药品加热
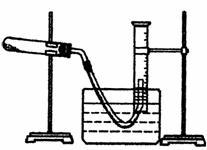 b.待有连续气泡产生时,将导气管出气端管口伸入盛满水的量筒内
b.待有连续气泡产生时,将导气管出气端管口伸入盛满水的量筒内
c.将导气管出气端管口伸入盛满水的量筒内
d.使量筒内液面与水槽中液面持平,然后读数
e.停止加热,使试管冷却至室温(如图,导管出口高于液面)
③按正确操作及顺序完成实验后,测得的气体体积比理论值低,可能的原因是
(4)请设计两种不加热制备氧气的实验方案(用化学方程式表示,反应物不得重复使用)。
26.(15分)已知A、B、C、D为中学常见的气体单质,甲、乙、丙、丁为常见的化合物,甲的水溶液呈碱性。它们之间有如图所示的转化关系(部分产物及反应条件已略去)。
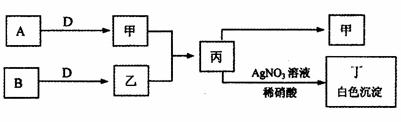
请回答:
 (1)乙的名称为
,丙转化丁的离子方程式为
。
(1)乙的名称为
,丙转化丁的离子方程式为
。
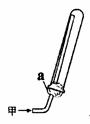
(2)实验室可通过多种方法制备甲,用右图所示装置收集甲,下列关于制取及收集甲实验的叙述正确的是 。
①甲气体不能用排水法收集
②实验室用丙一种药品可以制取甲
③右图的a为浸有稀H2SO4的棉花
|
(3)在A转化为甲的过程中,有右图所示的数据
(单位:mol/L)。在2min内A与D反应生成
甲的速度V(甲)= ,2min末
A的转化率为 。
(4)工业上通常以甲为原料制备HNO3。硝酸工业尾气中的NO和NO2对环境有污染,可用NaOH溶液吸收,尾气中NO与NO2按物质的量之比1:1被NaOH溶液吸收得到一种钠盐,该反应的化学方程式为 。
25.(15分)有机物A可用于配制水果香型香精,A-F可发生如下转化。B与C的相对分子质量相等,B分子中含有2个甲基,D分子中烷基上的一氯取代物有3种;F能使Br2的四氯化碳溶液褪色。
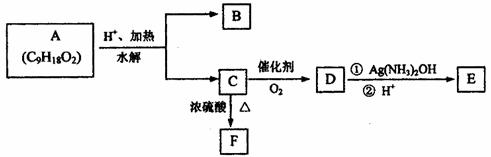
试回答:
(1)E中的官能团名称是 ;
|
a.氧化反应 b.加成反应 c.消去反应 d.酯化反应
(3)A的结构简式为 ;C→F的化学方程式为 。
(4)写出水解时能生成正戊酸且分子中含有3个甲基的A的同分异构体结构简式
。
(5)将B和C的混合物5mol放在足量O2中完全燃烧,生成CO2492.8L(标准状况)。则混合物中B的物质的量为 mol。
12.常温下,向0.1mol/L的H2SO4溶液中逐滴加入0.1mol/L的Ba(OH)2溶液,生成沉淀的质量与加入Ba(OH)2溶液的体积关系如图所示,下列说法中正确的是 ( )
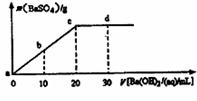 A.a~d溶液的pH:a<b<c<d
A.a~d溶液的pH:a<b<c<d
B.a~d溶液的导电能力:a<b<c<d
C.b处溶液的c(H+)与d处溶液的c(OH-)相等
D.c处溶液和d处溶液均呈碱性
|
第Ⅱ卷(非选择题 21-31题共11题 共180分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com