
13.下表中的数据是破坏1mol物质中的化学键所消耗的能量(在25℃,101kPa下测定):
|
物质 |
Cl2 |
Br2 |
I2 |
HCl |
HBr |
HI |
H2 |
|
能量(kJ) |
243 |
193 |
151 |
432 |
366 |
298 |
436 |
下列叙述正确的是
A.上述物质中所含能量最低的是I2
B.H2(g)+Cl2(g)=2HCl(g) 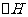 =+185kJ/mol
=+185kJ/mol
C.相同条件下,X2(X代表Cl、Br、I)分别与1 mol H2完全反应,Cl2放出的能量最多
D.在卤素单质X2(X代表Cl、Br、I)中,Cl-Cl键键能最大,所以氯气化学性质最稳定
12.下列有关实验的叙述中,正确的是
①用湿润的pH试纸测定溶液的pH
②不宜用瓷坩埚熔融氢氧化钠固体或碳酸钠固体
③可用加热法分离I2和NH4Cl的混合物
④可用稀硝酸洗涤“银镜反应”实验后附着在试管壁上的银
⑤向沸腾的NaOH稀溶液中滴加FeCl3饱和溶液,可以制得Fe(OH)3胶体
⑥实验室配制氯化亚铁溶液时,可先将氯化亚铁溶解在盐酸中,再加入蒸馏水稀释,最后加入少量铁粉
A.①②④ B.②⑧⑥ C.②④⑥ D.②③④⑤⑥
11.现有某温度下的KCl饱和溶液m1g,溶质的质量分数为 %,对其采取某种操作后析出mg无水KCl晶体,所得母液的质量为m2g,溶质的质量分数为
%,对其采取某种操作后析出mg无水KCl晶体,所得母液的质量为m2g,溶质的质量分数为 %,则下列关系正确的是
%,则下列关系正确的是
A.原条件下KCl的溶解度等于 g
B.
g
B.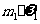 %-m=
%-m=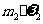 %
%
C. 一定等于
一定等于 D.
D. ≤m
≤m
10.A元素原子最外层电子数是次外层电子数的2倍,B元素原子次外层电子数是最外层电子数的2倍。则A、B元素
A.可能是同一主族元素 B.一定都是第二周期元素
C.可能都是第三周期元素 D.一定是两种非金属元素
9.2007年3月温家宝总理在十届全国人大五次会议上提出“要大力抓好节能降耗、保护环境”,下列举措与这一主题不相符的是
A.用“绿色化学”工艺,使原料完全转化为目标产物
B.推广燃煤脱硫技术,减少SO2污染
C.推广垃圾的分类存放、回收、处理
D.大量使用农药化肥以提高粮食产量
33.(8分)[化学-有机化学基础]
苯是重要的有机合成原料,下面是以苯为原料合成有机物D的路线:

(1)反应②、⑤所属的有机反应类型分别是:② ;⑤ 。
(2)写出反应③的化学方程式 。
(3)化合物D有多种同分异构体,其中一类是甲苯在苯环上的二取代物,该类物质的分子结构中,下列哪些基团不能两两同时存在 ;
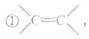 ②-CH3,③-NO2,④-OH,⑤-CHO,⑥-O-(醚键)
②-CH3,③-NO2,④-OH,⑤-CHO,⑥-O-(醚键)
A.①和③ B.④和⑤ C.①和⑤ D.②和⑥
其中,属于 -氨基酸的一种同分异构体的结构简式为
-氨基酸的一种同分异构体的结构简式为
32.(8分)[化学-物质结构与性质]
已知:A、B、C、D四种元素的原子序数依次增大。A与C原子的价电子构型相同,A的第一电离能是同族中最大的;B原子核外有三个未成对电子,C原子的价电子构型为3s1,D原子的3p轨道上有两对成对电子。
(1)A、B形成的10电子分子中,分子空间构型为 。该分子常常作为配位体形成络合物,请写出其与Zn(OH)2反应形成的络合物的化学式
(2)B原子和氧原子相比 的第一电离能更大。
(3)A分别与B、D形成的常见化合物在水中的溶解度都很大,其中 (写化学式)的溶解度更大,原因是 。
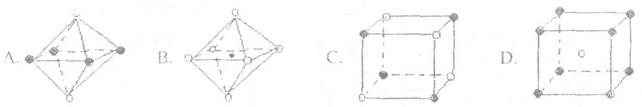
(4)下列图象是从某些晶体结构图中分割出来的部分结构图,试判断其中符合元素C、D形成的晶体结构的图象是 .
31.(8分)[化学--化学与技术]
重晶石矿(主要成分为硫酸钡)因为含有Fe2O3、MnO及炭质等杂质而常呈深褐色,工业上将重晶石矿粉碎后与硫酸、铝粉在反应槽中混台加热(即“漂白”),再经水洗等一系列工序制得白色的重晶石填料,广泛用作纸张、油漆等的填充剂。
重晶子填料的生产工艺流程为:
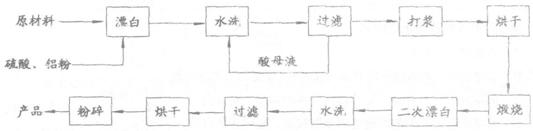
(1)在该流程中,为加快“浮白”速度,可采取的措施有
.
(2)硫酸起到了“漂白”的作用。请写出硫酸直接起到该作用时的化学方程式: 。
(3)铝粉也起到了“漂白”的作用。你认为,铝粉是如何起到该作用的? ;有同学认为,既然两次水洗,那么铝粉的作用就不大。你的解释是: 。
(4)煅烧的主要目的是 。
30.(14分)金属铝广泛应用于现代生产和日常生活中。
已知:4Al(s)+3O2(g)=2Al2O3(s) △H=-3351.4 kJ·mol-1
4Fe(s)+3O2(g)=2Fe2O3(s) △H=-1633.2 kJ·mol-1
 △H=-5518
kJ·mol-1
△H=-5518
kJ·mol-1
将铝用作燃料已成为现实。回答下列问题:
(1)写出工业制铝的阳极电极反应式 。
(2)①铝用作燃料相对于含碳燃料有明显优点,请你写出其中一条 ;
②铝用作燃料相对于氢气也有明显优点,但也有不足,即燃点高。若要在常温常压不使用催化剂的情况下点燃铝,除了应防止表面生成致密的氧化膜外,还应采取的措施是 。
(3)铝热反应在生产中的应用非常广泛。请写出Fe2O3(s)和Al(s)反应的热化学方程式 ;
铝热实验中能看到有熔融物生成,为探究该熔融物的成分,某学生查阅资料如下:
|
物质 |
A1 |
A12O3 |
Fe |
Fe2O3 |
|
熔点/℃ |
660 |
2054 |
1535 |
1462 |
|
沸点/℃ |
2467 |
2980 |
2750 |
- |
经分析,该同学推测,铝热反应所得到的熔融物应是铁铝合金。请设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝(简述实验操作、现象及结论) 。
[选做部分]
29.(16分)X、Y、Z、R 四种短周期元素,原子序数依次增大。已知:X、R处于同一主族,Y元素的最高正价和最低负价的绝对值相等,X与Y元素形成的一种物质是天然气的主要成分;Y与Z元素形成的一种气体会使大气产生“温室效应”。
请回答下列问题:
(1)X、Y、Z三元素所形成的单质或化合物之间,可按下图装置组成燃料电池。

若b口通入的是气体Z2,则a口通入的物质可以是 、 、 (分别填写只由一种、两种、三种元素组成的物质,用化学式表示);M电极的名称为 (填“正极”、“负极”或“阴极”、“阳极”);N电极的电极反应式为 (用化学式表示)。
(2)日常生活中我们经常用到的一种物质其主要成分的化学式为Y18X35Z2R,这种物质的学名为 ,制造这种物质的反应叫 ,写出该反应的化学方程式 。
(3)合成氨工业中,原料气制备的其中一个反应为:YZ+X2Z(g) YZ2+X2;
YZ2+X2;
已知该反应化学平衡常数K和温度T的关系如下表:
|
T(℃) |
700 |
800 |
830 |
1000 |
1200 |
|
K |
0.6 |
0.9 |
1.0 |
1.7 |
2.6 |
则下列有关的叙述正确的是 。
A.该反应 <0
<0
B.若绝热时(容器内外没有热量交换),改变某一条件平衡向逆反应方向移动,刚容器内气体的温度一定升高
C.若反应在830℃的温度达到平衡状态,反应容器内的四种物质的浓度则一定相等
D.该反应在某温度下,YZ、X2Z的物质的量浓度与时间的关系如下图所示,据此可计算得YZ的转化率为80%

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com