
11.按下图装置,持续通人X气体,可以看到a处固体变为红棕色,b处变蓝,c处得到液体,则X气体是
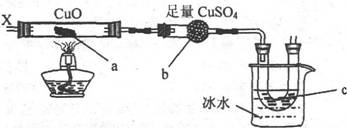
A.H2 B.CO和H2 C.NH3 D.CH3CH2OH(气)
10.X、Y、Z、R是1-18号元素中的四种元素,它们的原子结构有以下特点:①元素X原子的M层比L层少4个电子;②元素Y的2价阴离子的核外电子排布与氖原子相同;③元素Z原子的L层比M层多5个电子;④元素R原予的L层比K层多1个电子,其中金属性最强的是
A.X B.Y C.Z D.R
33.(8分)[化学--有机化学基础]
中国是《日内瓦协定书》缔约国,一贯反对使用化学武器,反对任何形式的化学武器扩散。苯氯乙酮是一种具有荷花香味的有强催泪性的杀伤化学毒剂,它的结构简式为
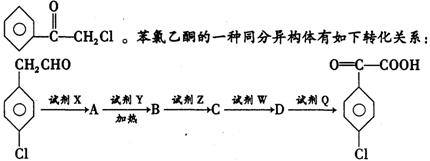
请写出:
(1)A、D的结构简式和X的化学式
A: ;D: ;X: ;
(2)C→D的反应类型:
(3)A→B的化学方程式: 。
32.(8分)[化学--物质结构与性质]
据最新一期的《新科学》杂志报道,科研人员在20℃、1个大气压和其它一定的实验条件下,给水施加一个弱电场,水就可以结成冰,称为“热冰”。下图是水和“热冰"微观结构的计算机模拟图。回答:

(1)以上信息体现了水分子具有 性,水分子中氧原子的杂化方式为 。
(2)参照热冰的图示,以一个水分子为中心,画出水分子间最基本的连接方式(用结构式表示)。
(3)固体二氧化碳外形似冰,受热气化无液体产生,俗称“干冰”。根据下图干冰的晶胞的结构回答:
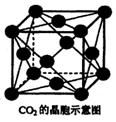
①一个晶胞中有 个二氧化碳分子;在二氧化碳分子中所含的化学键类型与数目有 ;在干冰中CO2的配位数是 。
②其堆积方式与干冰晶胞类型相同的金属有(答一种即可) ,其空间利用率为 。
31.(8分)[化学--化学与技术]
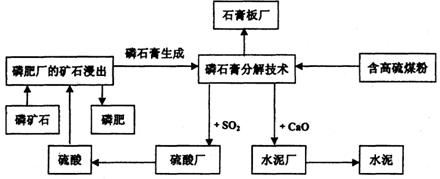
下面给出的图示是我省一综合企业集团中各工厂生产关系流程图,请你结合所学的知识对这一系统的技术原理、经济效益、环境影响、可持续发展的方面进行评价。(提示:CaSO4+C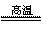 2CaO+2SO2↑+CO2↑)
2CaO+2SO2↑+CO2↑)
30.(14分)下列物质A、B、C、D、X、Y、Z之间转化关系如下图所示:
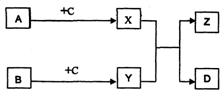
I.已知A、B为单质,D为无机化合物,其余均为有机化合物;A、B在一定条件下可化合生成D;Z具有芳香气味;X、Y均为生活中常见有机物;X在催化剂作用下可与B反应生成C;相同条件下,C的蒸气密度是H2密度的22倍。C中碳元素的质量分数为54.5%,氢元素的质量分数为9.1%,其余为氧元素。请写出:
①反应X+Y Z+D的化学方程式:
Z+D的化学方程式:
②A+C X的反应类型:
X的反应类型:
③Y的一种同分异构体的结构简式:
Ⅱ.已知A、B、C、D为单质,X、Y、Z为无机化合物。
(1)若B、D为同一种物质,请写出反应X+Y Z+D的化学方程式(写出一个即可):
Z+D的化学方程式(写出一个即可):
(2)若C、D为同一种物质:
①化合物Z中所含的元素为 (用A、B、C表示)。
②反应X+Y Z+D是否为氧化还原反应?请说明理由。
Z+D是否为氧化还原反应?请说明理由。
③某同学认为:C元素在化合物X、Y中呈现的化合价,必定是在一种物质中呈正价,在另一种物质中呈负价。请你判断该结论是否正确,并用有关的化学方程式证明你的结论。
[选做部分]
共6个题。考生从中选择2个物理题、1个化学题和1个生物题作答。
29.(14分)家用炒菜铁锅用水清洗放置后,出现红棕色的锈斑,某同学拟对其原理及条件进行探究:
(1)该同学准备了下列实验用品:20%NaCl溶液、蒸馏水、酚酞试液、KSCN溶液、新制氯水、纯铁丝、碳棒、U型管、导线等;请你帮他设计一实验方案来验证钢铁吸氧腐蚀的电极产物,简述操作过程并写出溶液中有关反应的离子方程式。
(2)该同学查阅有关资料知:氧气在液滴的表面和中心浓度不同;Fe2+遇K3[Fe(CN)6]产生蓝色沉淀:3Fe2++2[Fe(CN)6]3- ===Fe3[Fe(CN)6]2↓(蓝色)。该同学在一块光洁无锈的铁板上滴2滴含酚酞和K3[Fe(CN)6]的NaCl溶液,在空气中放置几分钟后,发现盐水滴边缘溶液显红色,盐水与铁板的接触面中心出现蓝色不溶物(见图示)。
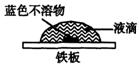
试判断该实验是否是铁的吸氧腐蚀。
若是,请写出正极反应方程式
若否,指出产生该现象的原因: 。
(3)将一铜棒、碳棒用导线连接后,插入内盛20%氯化钠溶液的U型管中,请根据此装置在下面两项中择一回答:
①若不是原电池,请说明原因:
(如果回答此题,下面的②不用回答)。
②若是原电池,现要求利用此装置(电极材料、溶液浓度均不变),采取适当的措施来提高电池的放电效率,该操作可以是:
(4)目前我国许多大型铜质文物露天放置腐蚀严重,在不影响观瞻效果的条件下,除用加保护层法保护外,请你再提出一项简单而有效的保护方法并简述其保护原理: 。
28.(14分)将不同量的H2O和CO2气体分别通入到一恒容密闭容器中进行反应:H2O+CO CO2+H2;得到以下三组数据,据此回答问题
CO2+H2;得到以下三组数据,据此回答问题
|
实验组 |
温度 |
起始量 |
平衡量 |
达到平衡 所需时间 |
||
|
H2O |
CO |
H2 |
CO |
|||
|
1 |
650℃ |
1mol |
2mol |
0.6mol |
1.4mol |
5min |
|
2 |
900℃ |
0.5mol |
1mol |
0.2mol |
0.8mol |
3min |
|
3 |
900℃ |
a |
b |
c |
d |
l |
(1)①由以上数据,实验1中以v(CO2)表示的反应速率为 。
②该反应在650℃时平衡常数数值为 ,该反应的逆反应为 (填“吸”或“放”)热反应。
③若实验3要达到与实验2相同的平衡状态,且t<3min,则a、b应满足的关系为: 。
(2)将0.2molCO2气体通入到100mL 3mol/L的NaOH溶液中,则所得溶液中各离子浓度关系正确的是 。
A.c(Na+)>c(HCO3-)>c(OH-)>c(CO32-)>c(H+)
B.c(HCO3-)+c(H2CO3)+c(CO32-)=2mol/L
C.c(Na+)=2[c(H2CO3)+c(HCO3-)+c(CO32-)]
D.c(Na+)+c(H+)=c(OH-)+2c(CO32-)+c(HCO3-)
(3)已知常温下H2CO3为二元弱酸,其第一、二步电离的电离常数分别为Ka1、Ka2,且Ka1≈104Ka2。Na2CO3溶液的第一、二步水解反应的平衡常致称为水解常数,分别为Kh1、Kh2。
①请推导出Kh1与Ka2的关系为 (用表达式表示);
②常温下,0.01mol/L的Na2CO3溶液的pH为 (用含Kh1的表达式表示)。
15.某溶液中大量存在以下五种离子:NO3-、SO42-、Fe3+、H+、M,其物质的量之比为n(NO3-):n(SO42-):n(Fe3+):n(H+):n(M)=2:3:1:3:1,则M可能是
A.Fe2+ B.Mg2+ C.Cl- D.Ba2+
第Ⅱ卷(必做120分+选做32分,共152分)
[必做部分]
14.下列对气体或溶液中的离子鉴定方案正确的是
A.将气体通入品红溶液中,品红溶液褪色,则证明该气体为SO2
B.向溶液中加入稀盐酸,生成能使澄清石灰水变浑浊的无色无味气体,证明原溶液中含CO32-
C.向溶液中加入硝酸酸化的BaCl2溶液,生成白色沉淀,证明原溶液中含SO42-
D.向溶液中加入浓NaOH溶液,加热后产生使湿润的pH试纸变蓝的气体,证明原溶液中含NH4+
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com