
27. (14分)有A、B、C、D、E五种短周期元素,原子序数依次增大。A元素原子内无中子;B、C、D同周期;B元素原子最外层电子数是次外层的2倍;D是地壳中含量最多的元素;E与A同主族。回答下列问题:
(1)画出E元素的离子结构示意图______________。
(2)D、E形成的一种化合物甲能与B、D形成的一种化合物乙反应,生成D的单质。写出甲与乙反应的化学方程式____________________________________。
(3)采用石墨为电极,电解A、D、E三种元素所形成的一种化合物,其阳极电极反应为__________________。
(4)A、C能形成一种常见气体丙,其分子为________分子(填“极性”或“非极性”);丙的电子式为______________;实验室制取气体丙的化学方程式为_______________。
(5)在一定条件下,lmol气体丙还可与D的单质反应,生成水蒸气和另一种气体,同时转移 个电子,并放出282.8kJ的热量,试写出该反应的热化学方程式
个电子,并放出282.8kJ的热量,试写出该反应的热化学方程式
__________________________________________________。
26. (18分)现有一份含有FeCl3和FeCl2固体的混合物,为测定各成分的含量进行如下两个实验:
实验1
①称取一定质量的样品,将样品溶解
②向溶解后的溶液中加入足量的AgNO3溶液,产生沉淀
③将沉淀过滤、洗涤、干燥得到白色固体17.22g
实验2
①称取与实验1中相同质量的样品,将样品溶解
②向溶解后的溶液中,通入足量的Cl2
③再向②所得溶液中加入足量的NaOH溶液,得到红褐色沉淀
④将沉淀过滤、洗涤后,加热灼烧,到质量不再减少,得到固体物质4g
根据实验回答下列问题:
(l)溶解过程中所用到的玻璃仪器有_____________________。
(2)实验室保存FeCl2溶液时通常会向其中加入少量试剂_________和_________。
(3)实验2中通入足量Cl2的目的是____________________________________。
涉及的化学反应的离子方程式是____________________________________。
(4)简述检验实验2的步骤④中沉淀已经洗涤干净的方法
_______________________________________________________________
_______________________________________________________________。
(5)加热FeCl3溶液,并将溶液蒸干时,通常不能得到FeCl3固体,请以平衡的观点解释其原因(方程式与文字相结合来说明)______________________________________。
(6)FeCl3溶液可以用于止血,主要是因为FeCl3溶液能使血液聚沉,这涉及到胶体的性质。以下关于胶体的说法不正确的是_____________(填写序号字母)。
A. 胶体粒子能透过滤纸,但不能透过半透膜
B. 胶体粒子具有较大的表面积,能吸附阳离子或阴离子,故在电场作用下会产生电泳现象
C. 只有胶体粒子能作布朗运动
D. 向Fe(OH)3胶体中滴加硫酸,会先出现红褐色沉淀,随后沉淀消失
E. 在蛋白质溶液中加入稀的CuSO4溶液,可使蛋白质盐析
(7)通过实验所得数据,计算得固体样品中FeCl3和FeCl2的物质的量之比为_________。
(8)实验室可以采用下列装置制取少量的FeCl3固体,已知FeCl3固体易潮解。(部分夹持仪器已略去)

该装置存在不足,往往无法得到FeCl3固体,请你对该装置提出合理的改进措施
_______________________________________________________________。
25. (16分)咖啡酸( )也叫3,4-二羟基桂皮酸,它存在于许多中药中,如野胡萝卜、光叶水苏、荞麦、木半夏等。咖啡酸有止血作用,对内脏的止血效果较好,毒性较小,还有镇咳、祛痰等疗效。
)也叫3,4-二羟基桂皮酸,它存在于许多中药中,如野胡萝卜、光叶水苏、荞麦、木半夏等。咖啡酸有止血作用,对内脏的止血效果较好,毒性较小,还有镇咳、祛痰等疗效。
(1)咖啡酸的分子式是____________________。
(2)咖啡酸不具有以下哪些化学性质__________(填写序号字母)。
A. 有浓硫酸、加热条件下能发生消去反应
B. 能与FeCl3溶液发生显色反应
C. 能发生银镜反应
D. 一定条件下能发生酯化反应
(3)1mol咖啡酸跟浓溴水反应时最多消耗______molBr2,反应类型有
____________________________________________________________。
(4)写出咖啡酸一定条件下发生加聚反应的方程式
____________________________________________________________。
写出咖啡酸与NaHCO3溶液反应的方程式
____________________________________________________________。
(5)写出符合下列条件的有机物A的结构简式
有机物A的分子式为C9H10O2;分子中有一个甲基;A能发生水解反应;在溶液中1molA能与2molNaOH反应
____________________________________________________________。
(6)将一定量咖啡酸与A的混合物点燃。该混合物完全燃烧消耗x L O2,并生成yg H2O和mLCO2(气体体积均为标准状况下的体积)。列出混合物中咖啡酸的物质的量的计算式____________________。
12. 下列说法正确的是
A.
若酸性 ,则相同条件下,溶液的pH大小为
,则相同条件下,溶液的pH大小为
B. 相同条件下,将pH=11的NaOH溶液和氨水分别稀释成pH=9的溶液,所加水的体积前者大
C.
pH=3的醋酸与pH=11的NaOH溶液等体积混合时,溶液中离子浓度的大小顺序是
D.
 的某二元弱酸盐
的某二元弱酸盐 溶液中,
溶液中,
第Ⅱ卷 (非选择题 共180分)
本卷共11小题,共180分。
11. 下列说法正确的是
A. 只有非金属能形成含氧酸和含氧酸盐
B. VIA族元素的氢化物中稳定性最好的,其沸点也最高
C. 同一主族的元素,原子半径越大其单质的熔点越高
D. 除稀有气体外的非金属元素,都能形成不同价态的含氧酸
10. 关于下列各装置图的叙述中,不正确的是
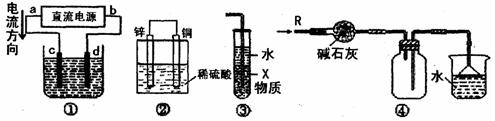
A. 若采用装置①精炼铜,则d极为粗铜,c极为纯铜,电解质溶液为CuSO4溶液
B. 装置②是原电池,能将化学能转化为电能,锌电极发生氧化反应
C. 装置③中X若为四氯化碳,可用于吸收氨气或氯化氢,并防止倒吸
D. 装置④可用于干燥、收集氨气,并吸收多余的氨气
9. 下列各组中的两种物质相互反应时,无论哪种过量,都可以用同一个离子方程式表示的是
①碳酸钠溶液与盐酸 ②偏铝酸钠溶液与盐酸 ③苯酚钠溶液与CO2
④硝酸银溶液与氨水 ⑤氯化铝溶液与氨水 ⑥碳酸氢钠溶液与澄清的石灰水
A. ③⑤ B. ①③⑥ C. 仅有⑤ D. ②④
8. 在下列条件下一定能大量共存的离子组是
A.
在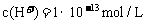 的溶液中:
的溶液中:
B.
在pH=1的溶液中:
C.
在能使紫色的石蕊试液变红的溶液中:
D.
在加入铝单质能产生大量氢气的溶液中: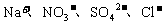
7. 有下列三个反应:①
②2
③ 下列说法正确的是
下列说法正确的是
A. ①②③中的氧化产物分别是
B. 根据以上方程式可以得到氧化性
C. 可以推理得到
D. 在③反应中当 参加反应时,有
参加反应时,有 被氧化
被氧化
6. 下列叙述中正确的是
A. 二氧化硅晶体和干冰晶体熔化时所克服的作用力类型相同
B. 分子晶体中一定含有共价键,离子晶体中一定含有离子键
C. 离子晶体都是强电解质
D. 检验淀粉是否已经全部水解时,可取少量样品,向其中加入银氨溶液,水浴加热,若能发生银镜反应说明淀粉已经全部水解
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com