
29.(13分)CO、C2H4均为常见的可燃性气体。
(1)已知在25℃ 101kPa时,CO的燃烧热为283 kJ/mol,且等质量的C2H4完全燃烧生成液态水,所放出的热量为CO完全燃烧放出热量的5.0倍,写出C2H4完全燃烧的热化学方程式是
。
(2)120℃ 101 kPa下,a mL由CO、C2H4组成的混合气体在bmL O2中完全燃烧后,恢复到原温度和压强。
①若混合气体与O2恰好完全反应,则混合气体中C2H4的体积分数为
(用含a、b的式子表示)。
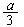 ②若燃烧后气体体积缩小了 mL ,则混合气体中CO的体积为
mL,b的取值范围(用含a的数学式表示)___________________________________。
②若燃烧后气体体积缩小了 mL ,则混合气体中CO的体积为
mL,b的取值范围(用含a的数学式表示)___________________________________。
28.(19分)聚合硫酸铁(PFS)是一种新型高效的无机高分子絮凝剂,广泛用于水的处理。用铁的氧化物为原料来制取聚合硫酸铁,实验步骤如下:

(1)实验室中用98%的硫酸配制3mol/L的硫酸,所需的玻璃仪器除量筒、烧杯、玻璃棒外,还需要 。
(a)容量瓶 (b)胶头滴管 (c)烧瓶
(2)用NaClO3氧化时反应方程式如下:
6FeSO4+NaClO3+3H2SO4 =3Fe2(SO4)3+NaCl+3H2O
若改用稀HNO3氧化,则反应的离子方程式为:
______________________________________________________________
已知1 mol HNO3价格0.16元、1 mol NaClO3价格0.45元,评价用HNO3代替NaClO3作氧化剂制取等量聚合硫酸铁(PFS)的利弊。
利是 ,
弊是 。
聚合硫酸铁溶液中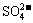 与Fe3+ 物质的量之比不是3︰2。根据下列供选择的试剂和基本操作,测定产品聚合硫酸铁溶液中
与Fe3+ 物质的量之比不是3︰2。根据下列供选择的试剂和基本操作,测定产品聚合硫酸铁溶液中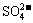 与Fe3+物质的量之比。
与Fe3+物质的量之比。
(3)测定时所需的试剂(填编号) 。
(a)NaOH (b)FeSO4 (c)BaCl2 (d)NaClO3
(4)需要测定 和 的质量(填写化合物的化学式)。
(5)测定(4)中两个实验数据的操作基本相同,该操作是(按操作先后顺序列出序号):________________ 。
(a)萃取、分液(b)过滤、洗涤(c)蒸发、结晶(d)冷却、称量 (e)烘干或灼烧
27.(19分)已知有机物A-I有如下转化关系,其中C在一定条件下最终能生成B。
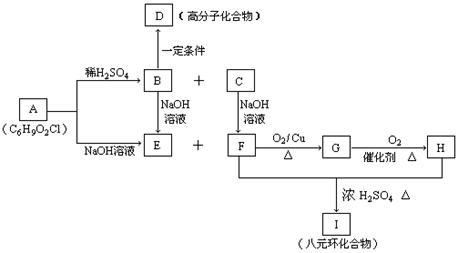
试回答:
⑴写出下列物质的化学式:
C的分子式_____________________;B的结构简式___________________________;
D的结构简式 ___________________________________________________________。
⑵写出下列反应化学方程式:
A→E+F_____________________________________________ ;
G→H _________________________________________ 。
⑶由C最终转化到B所经历的反应类型为(按反应先后顺序填写序号):
__________________________________________________________。
a.取代 b.消去 c.加成 d.水解 e.氧化 f.还原 g.加聚
⑷另一种有机物M与F相对分子质量相同,0.1mol M分别与足量Na和NaHCO3反应放出气体体积(同温同压)相等,写出M的结构简式:
____________________________________________________________________
26.(15分)下图中A-L均为中学化学中的常见物质,已知B、D、E、L常温下为密度比空气大的气体,D、E为单质,其它为化合物。A是一种淡黄色固体,G的焰色反应为黄色,F、G均能与L的水溶液反应放出B。
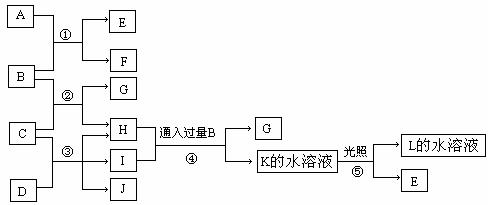
试回答:
(1)写出G的化学式__________________,B的电子式______________________。
(2)D是某化工生产的重要产品之一,该化工生产的名称是________________
(3)写出A与L的水溶液反应的化学方程式:_____________________________________________________________________
(4)某单质和C、L的水溶液均能反应放出氢气,写出该单质与C溶液反应的离子方程式:______________________________________________________________
(5)反应①和反应⑤生成等量E时转移的电子数之比为__________________________
29.(14分)Cu-Fe合金由于长时间置于空气中,表面产生了一怪氧化膜(成份为Fe2O3和CuO),现进行如下实验(以下气体体积均在标况下测得):
①将此合金块5.76g置于烧杯中,然后将稀H2SO4逐渐缓慢加入至过量,收集产生的气体为672mL,过滤得浅绿色溶液A,还有滤渣B。
 ②将滤渣B投入到一定浓度的HNO3中,完全溶解,得NO、NO2的混合气体896mL,经测定,同温同压下此混合气体对氢气的相对密度为17。
②将滤渣B投入到一定浓度的HNO3中,完全溶解,得NO、NO2的混合气体896mL,经测定,同温同压下此混合气体对氢气的相对密度为17。
③将①中所得滤液加入到同浓度足量的HNO3中,用排水法收集一烧瓶气体,再向烧瓶中通入224mL O2,气体恰好完全溶于水。
(1)A中存在的阳离子有 、 。
(2)B的单质为 ,质量为 g。
(3)③中被HNO3氧化了的阳离子的物质的量为 mol。
(4)此合金块中氧元素的质量为 g。
27.(18分)有机物A是芳香族化合物,其分子式为CxHyOz,它的苯环上的一元取代物只有2种,有关A的一系列转化关系如下图所示:
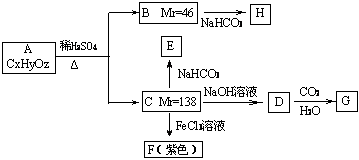
(1)C中所含的官能团有 。
(2)A的结构简式: 。
(3)书写化学反应方程式:
|
|
 C
E:
。
C
E:
。
 D
G:
。
D
G:
。
(4)已知23gB蒸气完全燃烧生成液态水时,放出akJ的热量,试写出该物质燃烧热的化学方程式 。
(5)化合物M也是一种芳香族化合物,其分子式中比A多2个氢原子,为CxHy+2Oz,它的苯环上有3个互为同位的取代基。等量的M分别和Na、NaOH、NaHCO3完全反应,消耗的Na、NaOH、NaHCO3物质的量之比为3:2:1,则:
M的结构简式为 。
M发生缩聚反应所得高聚物的结构简式为 。
26.(14分)已知:下图中B、G为常见金属单质A、J为非金属气体单质,其余为常见物质或其水溶液,其中E为蓝色沉淀,B在A气体中燃烧产生棕色烟,I的焰色反应为黄色,F为无色气体,遇空气后变为红棕色。
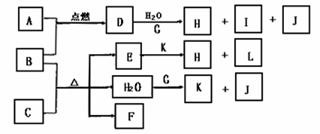
回答下列问题:
(1)写出:①D化学式 ,其水溶液显 性,试用离子方程式说明原因: 。
②K物质中所含的化学键有 ,其中电子式为 。
(2)写出B与C反应的离子方程式 。
(3)1molG与足量的水反应,生成还原产物的质量为 g。
(4)J与另一种常见的无色气体单质在K溶液中可构成一种燃料电池,写出该电池负极的电极反应式 。
13.用惰性电极电解一定浓度的硫酸铜溶液,长时间通电后,向所得溶液中加入0.2mol Cu(OH)2,恰好恢复到电解前的浓度和pH。则电解过程中转移电子的总物质的量为
( )
A.0.2mol B.0.4mol C.0.6mol D.0.8mol
第II卷(非选择题,共174分)
12.下列说法不正确的是 ( )
A.0.1mol/L
的Na2CO3溶液中:c(OH-)=
c (H+)+ c (HCO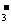 )+2 c (H2CO3)
)+2 c (H2CO3)
B.分别取等体积等pH的CH3COOH和HCl,都稀释相同的倍数后测pH,CH3COOH
|
C.取等体积等物质的量浓度的CH3COOH和HCl,分别加入相同的Zn粒,比较反应速率,CH3COOH与Zn反应慢
D.溶质为NaOH和CH3COONa的混合液中,离子浓度的关系一定有:
c(Na+)> c (OH)> c (CH3COO-)> c (H+)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com