
30.(12分)已知可逆反应: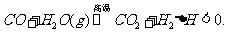
请回答下列问题:
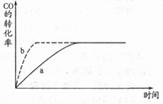
(1)图中曲线a表示反应进行过程中CO的转化率随时间变化的关系,若要改变起始条件,使反应过程按b曲线进行,可采取的措施是_____ (填序号)
A.升高温度 B.加催化剂 C.加压 D.增加CO的用量 E.扩大容器的体积
(2)830K时,若起始时c(CO)=2m01.L-1,c(H20)=3m01.L-1,经5min后该反应达到平衡,此时CO的转化率为60%,该时间段内,此反应的平均速率v(CO)=____;若起始时,c(CO)=4m01.L-1,c(H20)____,达到平衡时,反应体系中各组分的百分含量与上述情况相同,此时该反应的化学平衡常数为___。
(3)830K时,若起始时,c(CO)=2m01.L-1,c(H2O)=6m01.L-1,达到化学平衡后,水蒸气的转化率为____。
(4)TK时,起始浓度为:c(CO)=am01.L-1,c(H2O)=bm01.L-1,达到化学平衡后,c(H2)=cm01.L-1;若a、b、c之间的关系满足:ab>(a+b)·c,则此时T____830。(填“大于”“等于”或“小于”)
[选做部分]
29.(14分)A、B、C、D、E、F六种短周期主族元素,其核电荷数依次增大,已知元素A和C可形成两种常温下均为液体的化合物,B原子最外层电子数是最内层电子数的两倍,A与D、C与F分别处于同一主族且A、D质子数之和是C、F质子数之和的一半,18gE与足量盐酸反应生成标准状况下的H222.4L。
请按要求回答:
(1)由A、C、D三种元素形成的化合物X中含有的化学键类型为_______。
(2)A、D、F三种元素形成的化合物Y溶液中的微粒浓度之间存在如下关系(请填写下式中的空白,每空只填一种微粒浓度的符号)。
c(H+)+_______:c(OH-)+ _______。
(3)E、F构成的化合物能与水反应,写出化学方程式_______。
(4)①写出单质D与乙醇反应的化学方程式_______。
②A、B、C三种元素可以形成最简式为A4B2C的有机物,该有机物与足量X水溶液反应得到的两种产物中含有相同数目的B原子。写出该反应的化学方程式_____。
(5)A和B组成的化合物M,每个分子中含有18个电子,常温常压下,0.5molM完全燃烧放出780kJ的热量,请写出表示M完全燃烧的热化学方程式____。
28.(16分)
I.下图是一个制取氯气并以氯气为原料进行特定反应的装置。
试回答下列问题:
(1)实验开始时,先点燃A处的酒精灯,打开旋塞K,让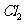 充满整个装置,再点燃D处的酒精灯,连接上E装置,
充满整个装置,再点燃D处的酒精灯,连接上E装置,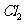 通过C瓶后进入D,D装置的硬质玻璃管内盛有炭粉,发生氧化还原反应,其产物为
通过C瓶后进入D,D装置的硬质玻璃管内盛有炭粉,发生氧化还原反应,其产物为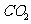 和HCl,试写出D中发生反应的化学方程式_______,装置C的作用是_______。
和HCl,试写出D中发生反应的化学方程式_______,装置C的作用是_______。
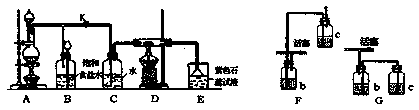
(2)在E处石蕊试液由紫色变为红色,再变为五色,其原因是_______。
(3)若将E处烧杯中的溶液改为澄清石灰水,反应过程中的现象为_______。
(选填序号)
A.有白色沉淀生成 B.无明显现象 C.首先生成白色沉淀而后白色沉淀消失
(4)在选取试剂正确且适量前提下,反应开始后当关闭活塞K时,发现B的长颈漏斗中的液面上升不明显,你认为可能的原因是_______,证实该原因的操作方法是_______。
(5)把制得的足量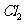 通到
通到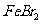 溶液时反应的离子方程式为_______。
溶液时反应的离子方程式为_______。
Ⅱ.若采用A、B,用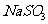 ,固体与体积比浓度为1:1的硫酸制取
,固体与体积比浓度为1:1的硫酸制取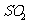 气体。
气体。
(1)此时,B中的液体一般应选用_______。
(2)用F或C代替B部分是否可行?若不可行,简要说明理由。_______。
Ⅲ.若将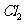 和
和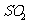 分别通人滴有酚酞的NaOH溶液中,红色均褪去。请你设计一个实验,说明
分别通人滴有酚酞的NaOH溶液中,红色均褪去。请你设计一个实验,说明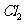 和
和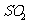 使该溶液褪色的原理是不同的。
使该溶液褪色的原理是不同的。
15.关于下列装置图的叙述中,不正确的是
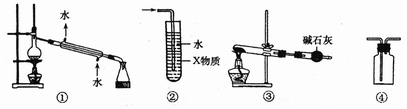
A.装置①常用于分离沸点差别较大,且互相溶解的液体混合物
B.装置②中X若为四氯化碳,可用此装置吸收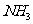 或HCl,并防止发生倒吸
或HCl,并防止发生倒吸
C.以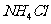 为原料,在实验室中可用装置③制备少量
为原料,在实验室中可用装置③制备少量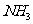
D.装置④可用于收集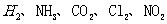 等气体
等气体
第Ⅱ卷(必做120分+选做32分,共152分)
[必做部分]
14.纽扣电池的两极材料分别为锌和氧化银,电解质溶液为KOH溶液,其总反应式为:
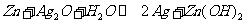 下列说法正确的是
下列说法正确的是
A. 放电时,溶液中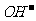 向正极移动,
向正极移动,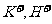 向负极移动
向负极移动
B.放电时,正极反应式为: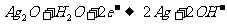
C.在电池放电过程中,电解质溶液的酸碱性保持不变
D.放电时,锌是负极,发生还原反应,电极反应式为: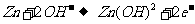
13.呋喃西林属于硝基呋喃类抗生素,曾作为广谱抗菌药,在动物养殖中发挥杀菌防腐 作用。但后来发现具有致突变和致癌作用。2002年4月,农业部规定,硝基呋喃类化合物禁止用于所有食品动物。呋喃西林的结构简式是:
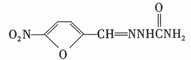
下列说法正确的是
A. 呋喃西林中含有苯环 B.呋喃西林的化学式为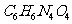
C.呋喃西林的摩尔质量为198 D.呋喃西林不能发生加成反应
12.有一瓶五色溶液,可能含有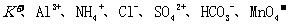 离子中的几种。为确定其成分,做了如下实验:①取部分溶液,加入适量
离子中的几种。为确定其成分,做了如下实验:①取部分溶液,加入适量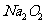 固体,产生无色无味的气体和白色沉淀,再加入足量的NaOH溶液后白色沉淀部分溶解;②另取部分溶液,加入
固体,产生无色无味的气体和白色沉淀,再加入足量的NaOH溶液后白色沉淀部分溶解;②另取部分溶液,加入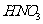 酸化的
酸化的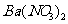 溶液,有白色沉淀产生。下列推断正确的是
溶液,有白色沉淀产生。下列推断正确的是
A.肯定有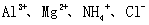 B.肯定有
B.肯定有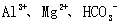
C.肯定有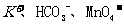 D.肯定有
D.肯定有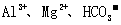
11.下列叙述中,正确的是
①根据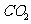 分子结构可推知,COS分子中各原子也达到了8电子结构 ②将
分子结构可推知,COS分子中各原子也达到了8电子结构 ②将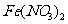 溶液加热蒸发至干并灼烧,最后得到红棕色粉末 ③向
溶液加热蒸发至干并灼烧,最后得到红棕色粉末 ③向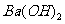 溶液中滴加
溶液中滴加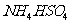 溶液至刚好沉淀完全的离子方程为:
溶液至刚好沉淀完全的离子方程为:
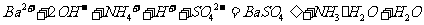
④NaHS溶液中,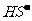 水解的离子方程式为:
水解的离子方程式为: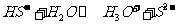
⑤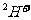 结合
结合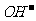 的能力比
的能力比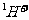 的强
的强
A.②④⑤ B.①②③ C.①③④ D.①②③④⑤
10.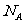 表示阿伏加德罗常数的值,下列说法正确的是
表示阿伏加德罗常数的值,下列说法正确的是
A. 1mol羟基(-OH)中所含电子数为7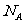
B.实验室中用含4molHCl的浓盐酸跟足量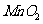 反应,可制得
反应,可制得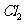 的分子数为
的分子数为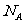
C.常温常压下,1mol 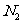 和NO的混合气体中含有的原子数为2
和NO的混合气体中含有的原子数为2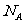
D.标准状况下,22.4L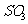 中所含原子数为4
中所含原子数为4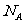
9.据报道,碳纳米管是碳原子形成的大分子,其导电性是铜的1万倍; 是可用作烈性炸药的一种分子,下列说法正确的是
是可用作烈性炸药的一种分子,下列说法正确的是
A.金刚石与碳纳米管互为同分异构体
B. 与
与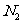 互为同素异形体
互为同素异形体
C. 的中子数和
的中子数和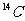 的质子数相等
的质子数相等
D.C原子半径比N原子半径小
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com