
4.下列不属于无机非金属材料的是
A.合金钢 B.光导纤维 C.钢化玻璃 D.氧化铝陶瓷
3.下列单质中,最不容易跟氢气发生反应的是
A.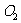 B.
B.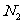 C.
C.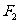 D.
D.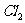
2.下列气体不能用浓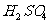 干燥的是
干燥的是
A.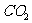 B.
B.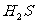 C.
C.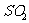 D.
D.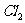
1.引起下列环境污染的原因不正确的是
A.含磷洗衣粉、农药等会造成水体污染
B.氮的氧化物排放到空气中,在日光的照射下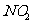 能使氧气经过复杂的反应生成臭氧,臭氧与空气中的一些碳氢化合物发生作用形成光化学烟雾造成空气的污染
能使氧气经过复杂的反应生成臭氧,臭氧与空气中的一些碳氢化合物发生作用形成光化学烟雾造成空气的污染
C.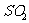 、
、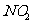 或
或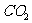 都会导致酸雨的形成
都会导致酸雨的形成
D.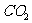 和氟氯烃等物质的大量排放会造成温室效应的加剧
和氟氯烃等物质的大量排放会造成温室效应的加剧
26.(6分)实验室里迅速制备少量氯气可利用如下反应:
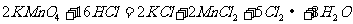
此反应不需要加热,而且对盐酸的浓度要求不高。
(1)此反应中的氧化剂是______________(填名称)。
(2)若参加反应的氧化剂的质量是158g,则产生的氯气在标准状况下的体积为被氧化的还原剂的物质的量为________________。
25.(13分)电子工业常用30%的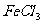 溶液腐蚀敷在绝缘版上的铜箔,制造印刷电路板。
溶液腐蚀敷在绝缘版上的铜箔,制造印刷电路板。
(1)检验溶液中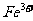 存在的试剂是___________,证明
存在的试剂是___________,证明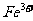 存在的现象是__________。
存在的现象是__________。
(2)写出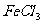 溶液与金属铜发生反应的化学方程式:______________。
溶液与金属铜发生反应的化学方程式:______________。
(3)某工程师为了从使用过的腐蚀废液中回收铜,并重新获得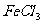 溶液,准备采用下列步骤:
溶液,准备采用下列步骤:
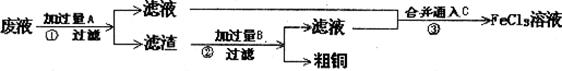
I.写出下列物质的化学式:A__________、B_________、C_________。
II.写出一个能证明还原性Fe比Cu强的离子方程式:___________________。
III.写出步骤③发生反应的离子方程式:______________________。
24.(10分)化工生产中常见到“三酸两碱”,“三酸”指硝酸、硫酸和盐酸;“两碱”指烧碱和纯碱。
(1)从物质分类角度看,名称与分类不符合的一种物质是_____________(填化学式)。
(2)“三酸”与“两碱”之间均可反应,若用化学方程式表示有六个(酸过量时);若用离子方程式表示却只有两个(酸过量时),请写出这两个离子方程式____________、___________。
(3)“三酸”常用于溶解金属和金属氧化物,下列块状金属在常温时能全部溶于足量浓硝酸的是____________________。
A.Ag B.Cu C.Al D、Fe
23.(12分)某研究性学习小组查阅资料得知,漂白粉与硫酸溶液反应可制取氯气,化学方程式为: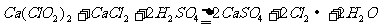
他们设计如下实验制取氯气并验证其性质。
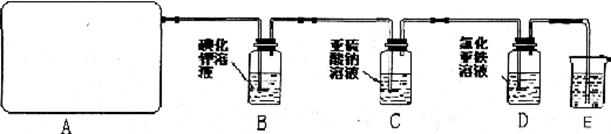
试回答:
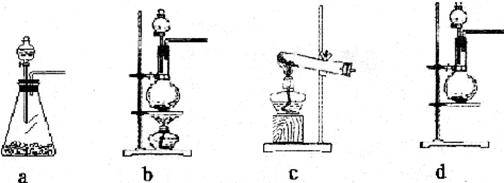
(1)该实验中A部分的装置是_____________(填写装置的序号)
(2)请你帮助他们设计一个实验,证明洗气瓶C中的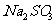 ,已被氧化(简述实验步骤)。_____________________________________________________________________________________________________________________________________________________________.
,已被氧化(简述实验步骤)。_____________________________________________________________________________________________________________________________________________________________.
(3) 写出B装置中发生反应的离子方程式:________________;
D装置中的实验现象是:_________________________。
(4)工业上常用漂白粉与酸反应放出氯气的质量对漂白粉质量的百分比(x%)来表示漂白粉质量的优劣。研究性小组进行如下实验:称取漂白粉2 g,加水研细后,转入250 m L容量瓶中,用水稀释至刻度。摇匀后,取出25mL,入锥形瓶中,加入过量的KI溶液和过量的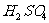 溶液,静置。待完全反应后,用
溶液,静置。待完全反应后,用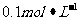 的
的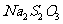 溶液测定反应中生成的碘,反应式为:
溶液测定反应中生成的碘,反应式为: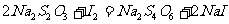 ,反应用去
,反应用去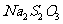 溶液20mL。该漂白粉的
溶液20mL。该漂白粉的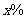 =________________________.
=________________________.
22.(8分)某学生用质量分数为98%、密度为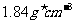 的浓硫酸,配制
的浓硫酸,配制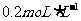 的硫酸溶液500 m L。试回答下列问题:
的硫酸溶液500 m L。试回答下列问题:
(1)计算所需浓硫酸的体积__________________.
(2)从下列用品中选出实验所需要的仪器_________________(填序号)。
A.1000mL烧杯 B.100mL烧杯 C.10mL量筒 D.100mL量筒 E.500mL容量瓶 F.1000mL容量瓶 G.广口瓶 H.托盘天平 I.玻璃棒
除选用上述仪器外,尚缺少必要的仪器或用品是_____________________。
(3)该学生根据计算结果,进行如下实验操作:①用量筒量取计算所需体积的浓硫酸;②向量筒中加入少量蒸馏水,并用玻璃棒搅拌;③立即将稀释后的溶液转入容量瓶中;④然后用量筒往容量瓶中加蒸馏水至刻度线;⑤把容量瓶盖盖紧,再振荡摇匀。
指出上述实验中错误的操作是___________________(用编号表示)。
21.(7分) 已知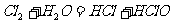 。为了探究
。为了探究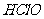 的漂白性,某同学设计了如下的实验。
的漂白性,某同学设计了如下的实验。
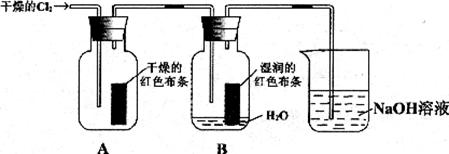
(1)通入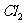 后,从集气瓶A中干燥的红色布条的现象可得出的结论是_________;从集气瓶B中湿润的红色布条的现象可得出的结论是________。
后,从集气瓶A中干燥的红色布条的现象可得出的结论是_________;从集气瓶B中湿润的红色布条的现象可得出的结论是________。
(2)为了确证是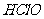 使湿润的红色布条褪色,你认为还应增加的实验是_____________.
使湿润的红色布条褪色,你认为还应增加的实验是_____________.
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com