
13.已知元素X的基态原子最外层电子排布为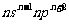 ,则X元素的原子序数为
,则X元素的原子序数为
A.9 B.10 C.17 D.18
12.下列说法不正确的是
A.在石墨的层状结构中,每个最小六元碳环平均含有2个碳原子
B.NaCI和SiC晶体熔化时,克服粒子间作用力的类型不相同
C.MgS晶体中电子总数与质子总数之比为l:l
D.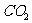 、
、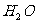 、
、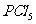 分子中各原子最外层都满足8电子结构
分子中各原子最外层都满足8电子结构
11.韩国首尔大学科学家将水置于一个足够强的电场中,在20口时,水分子瞬间凝固形成了“暖冰”。下列关于“暖冰”的说法正确的是
A.水分子中的3个原子位于同一条直线上
B.水凝固形成20□时的“暖冰”所发生的变化是化学变化
C.水分子中各原子均满足8电子稳定结构
D.在电场作用下,水分子间更易形成氢键,因而可以制得“暖冰”
10.气态中性基态原子的原子核外电子排布发生如下变化,吸收能量最多的是
A.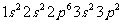 →
→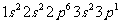
B.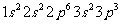 →
→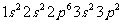
C.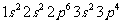 →
→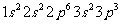
D.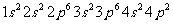 →
→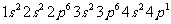
9.下列分子或离子的立体结构,其中正确的是
A.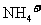 为正四面体形 B.
为正四面体形 B.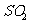 为直线形
为直线形
C.HCN为平面三角形 D.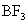 为三角锥形
为三角锥形
8.A元素的阳离子与B元素的阴离子具有相同的电子层结构,有关两元素的下列叙述正确的是
A.离子半径A>B B.A的正价与B的负价绝对值一定相等
C.A的电负性小于B的电负性 D.A的第一电离能大于B的第一电离能
7.现有四种元素的基态原子的电子排布式如下①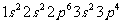 ②
②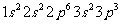 ③
③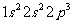 ;④
;④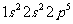 。则下列有关比较中正确的是
。则下列有关比较中正确的是
A.第一电离能:④>③>②>① B.原子半径:④>③>②>①
C.电负性:④>③>②>① D.最高正化合价:④>③=②>①
6.氨气分子空间构型是三角锥形,而甲烷是正四面体形,这是因为
A.两种分子的中心原子杂化轨道类型不同,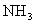 为
为 型杂化,而
型杂化,而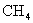 是
是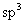 型杂化。
型杂化。
B.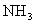 分子中N原子形成三个杂化轨道,
分子中N原子形成三个杂化轨道,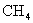 分子中C原子形成4个杂化轨道。
分子中C原子形成4个杂化轨道。
C.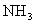 分子中有一对未成键的孤对电子,它对成键电子的排斥作用较强。
分子中有一对未成键的孤对电子,它对成键电子的排斥作用较强。
D.氨气是共价化合物而甲烷是离子化合物。
5.20世纪80年代后,人们发现和证实了碳的另一类单质,它们是由一系列偶数个碳原子组成的分子,其中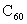 最具代表性。下图所示为n个
最具代表性。下图所示为n个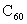 连接而成的物质X。
连接而成的物质X。
下列有关物质X的说汉不正确的是
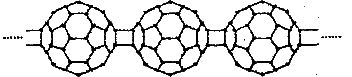
A.X难溶于水 B.一定条件下X可与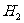 发生加成反应
发生加成反应
C.X的摩尔质量为720n D.X是碳的一种同素异形体
4.下列叙述正确的是
A.原子晶体中除非极性共价键外不存在其他类型的化学键
B.含有共价键的化合物一定是共价化合物
C.含有离子键的化合物一定是离子化合物
D.双原子分子中的共价键一定是非极性键
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com