
7.2007年3月21日,我国公布了111号元素Rg的中文名称。该元素名称及所在周期是
A.纶 第七周期 B.镭 第七周期
C.铼 第六周期 D.氡 第六周期
22.(11分)有A、B、C、D四种元素,其中A元素和B元素的原子都有1个未成对电子,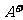 比
比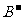 少一个电子层,B原子得一个电子填入3p轨道后,3p轨道已充满;C原子的p轨道中有3个未成对电子,其气态氢化物在水中的溶解度在同族元素所形成的氢化物中最大;D的最高化合价和最低化合价的代数和为4,其最高价氧化物中含D的质量分数为40%,且其核内质子数等于中子数。R是由A、D两元素形成的离子化合物,其中
少一个电子层,B原子得一个电子填入3p轨道后,3p轨道已充满;C原子的p轨道中有3个未成对电子,其气态氢化物在水中的溶解度在同族元素所形成的氢化物中最大;D的最高化合价和最低化合价的代数和为4,其最高价氧化物中含D的质量分数为40%,且其核内质子数等于中子数。R是由A、D两元素形成的离子化合物,其中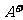 与
与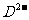 离子数之比为2:l。
离子数之比为2:l。
请回答下列问题:
(1)A元素形成的晶体属于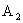 密堆积型式,则其晶体内晶胞类型应属于__________________ (填写“六方”、“面心立方”或“体心立方”)。
密堆积型式,则其晶体内晶胞类型应属于__________________ (填写“六方”、“面心立方”或“体心立方”)。
(2)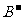 的电子排布式为______________________________,在
的电子排布式为______________________________,在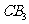 分子中C元素原子的原子轨道发生的是_____________变化。
分子中C元素原子的原子轨道发生的是_____________变化。
(3)C的氢化物的空间构型为___________。
(4)B元素的电负性___________D元素的电负性(填“>”,“<”或“=”);用一个化学方程式说明B、 D两元素形成的单质的氧化性强弱:________________________________。
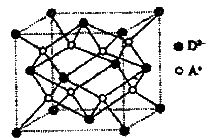
(5)如图所示是R形成的晶体的晶胞,设晶胞的边长为acm。
试计算R晶体的密度。(阿伏加德罗常数用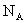 表示)
表示)
21.(13分)有A、B、C、D、E、F、G七种元素,除E为第四周期元素外其余均为短周期元素。A、E、G位于元素周期表的s区,其余元素位于p区,A、E的原子外围电子层排布相同,A的原子中没有成对电子;B元素基态原子中电子占据三种能量不同的原子轨道且每种轨道中的电子总数相同;C元素原子的外围电子层排布式为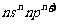 ;D元素的第一电离能列同周期主族元素第三高;F的基态原子核外成对电子数是成单电子数的3倍:G的基态原子占据两种形状的原子轨道,且两种形状轨道中的电子总数均相同。回答下列问题:
;D元素的第一电离能列同周期主族元素第三高;F的基态原子核外成对电子数是成单电子数的3倍:G的基态原子占据两种形状的原子轨道,且两种形状轨道中的电子总数均相同。回答下列问题:
(1)写出下列元素的符号:A______,B______,c______,D_____,E______F______,G______;
(2)D的前一元素第一电离能高于D的原因:________________________________________ ;
(3)由A、B、C形成的ABC分子中,含有_______个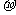 键,_______个
键,_______个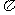 键;
键;
(4)由D、E、F、G形成的盐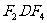 、
、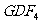 的共熔体在冷却时首先析出的物质是________(写化学式),原因是________________________________________;
的共熔体在冷却时首先析出的物质是________(写化学式),原因是________________________________________;
20.(9分)下表是元素周期表的一部分。表中所列的字母分别代表一种化学元素。
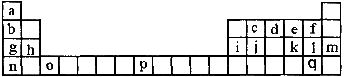
试回答下列问题:
(1)请写出元素O的基态原子电子排布式_________________________________________,g元素的价电子的四个量子数依次是_________________________
(2)d的氢化物中心原子的杂化方式是__________________________________________
(3)o元素所在族的符号是__________________________________
(4)d的氢化物与l的氢化物反应后的产物中包含的化学键是_______________________
(5)f、1、q的氢化物中沸点最高的是___________________。(写化学式)
(6) j原子形成的晶体与j原子跟c原子以1:l相互交替结合而形成的jc晶体类型相同。则j晶体的熔点__________jc晶体的熔点(填“大于…”“等于…”“小于”)原因是: ________________________________________________________
19.(8分)下图为周期表中部分元素某种性质(x值),随原子序数变化的关系。
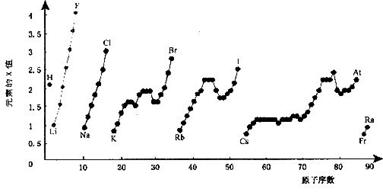
(1)短周期中原子核外p亚层上电子数与s亚层上电子总数相等的元素是________和________(写元素符号)。
(2)同主族内不同元素的X值变化的特点是____________________________________同周期内,随着原子序数的增大,X值变化总趋势是_________________,周期表中X值的这种变化特点体现了元素性质的______________变化规律。
(3)X值较小的元素集中在元素周期表的_____________
a.左下角 b.右上角 c.分界线附近
(4)下列关于元素此性质的说法中正确的是_____________(选填代号)。
a.X值可反映元素最高正化合价的变化规律
b.X值可反映原子在分子中吸引电子的能力
c.X值大小可用来衡量元素金属性和非金属性的强弱
18.(7分)氮及其化合物在生活、生产和科技等方面有重要的应用。请回答下列问题:
(1)氮元素基态原子的价电子排布式为_________________
(2)在氮气分子中,氮原子之间存在着_________个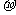 键和_______个
键和_______个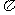 键:
键:
(3)氮元素的氢化物--NH3是一种易液化的气体,该气体易液化的原因是
______________________________________________________________
(4)配合物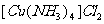 中含有4个配位键,若用2个
中含有4个配位键,若用2个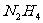 代替其中的2个
代替其中的2个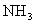 ,得到的配合物
,得到的配合物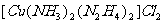 中含有配位键的个数为___________
中含有配位键的个数为___________
17.(4分)氯化铝是共价化合物,其气态分子为二聚体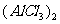 ,其结构式为
,其结构式为
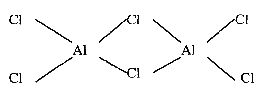
在你认为是配位键的短线上直接加上箭头符号。
16.经X射线分析鉴定,钛酸钡晶体属于立方晶系(如下图所示,且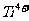 、
、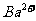 和
和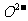 互相接触)下列说法不正确的是
互相接触)下列说法不正确的是
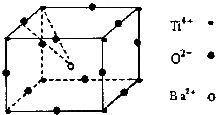
A.该晶体化学式为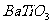
B.该晶体属于离子晶体,熔点较高
C.与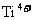 配位的氧离子构成正四面体
配位的氧离子构成正四面体
D.与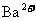 配位的氧离子个数为12
配位的氧离子个数为12
第Ⅱ卷(共52分)
15.某有机物(名称乙烯酮)的结构简式为: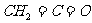 ,下列描述正确的是
,下列描述正确的是
A.该分子中共有2个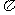 健、2个
健、2个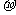 健
健
B.该分子属非极性分子
C.该分子是直线型分子
D.该分子中2个碳原子的杂化方式是不同的
14.下列分子中含有两个手性碳原子的是
A.乳酸 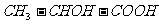
B.甘油 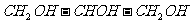
C.脱氧核糖 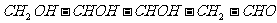
D.核糖 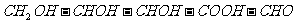
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com