
27.(15分)现有五种离子化合物A、B、C、D和E,都是由下表中离子形成的:
|
阳离子 |
Ag+ Ba2+ A1+ |
|
阴离子 |
OH- C1- SO42- |
为鉴别它们,分别完成以下实验,其结果是:
a.B和D都不溶于水,也不容于酸;
b.A溶于水后,与上述某阳离子反应可生成B,且A溶液与过量氨水反应生成白色沉淀;
c.C溶于水后,与上述某阳离子反应可生成D,且C溶液与过量氨水反应生成白色沉淀。
d.E溶于水后,与上述某阴离子反应可生成B;
e.A溶液与适量E溶液反应生成沉淀,再加入过量E溶液,沉淀量减少,但不消失。
请根据上述实验结果,填空:
(1)写出化合物的化学式:A ,B ,C ,E 。
(2)A溶液与过量的E溶液反应后,最终得到的化学式是 。
26.(16分)用A+、B-、C2―、D、E、F、G和H分别表示含有18个电子的八种微粒(离子或分子),请回答:
(1)A元素是 ① 、B元素是 ② 、C元素是 ③ (用元素符号表示)。
(2)D是由两种元素组成的双原子分子,其分子式是 ④ 。
(3)E是所有含18个电子的微粒中氧化能力最强的分子,其分子式是 ⑤ 。
(4)F是由两种元素组成的三原子分子,其分子式是 ⑥ ,电子式是 ⑦ 。
(5)G分子中含有4个原子,其分子式是 ⑧ 。
(6)H分子中含有8个原子,其分子式是 ⑨ 。
13.在一定条件下,将钠与氧气反应的生成物1.5g 溶于水,所得溶液恰好能被80mL浓度为0.50mol/L的HCl溶液中和,则该生成物的成分是
A Na2O B Na2O2 C Na2O和Na2O2 D Na2O2和NaO2
第Ⅱ卷
本试卷共10小题,共174分。
12.仔细分析下列表格中烃的排列规律,判断排列在第15位烃的分子式是
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
…… |
|
C2H2 |
C2H4 |
C2H6 |
C3H4 |
C3H6 |
C3H8 |
C4H6 |
C4H8 |
C4H10 |
…… |
A C6H12 B C6H14 C C7H12 D C7H14
11.下列氧化还原反应中,水作为氧化剂的是
A CO+H2O CO2+H2
B 3NO2+H2O=2HNO3+NO
CO2+H2
B 3NO2+H2O=2HNO3+NO
C 2Na2O2+2H2O=4NaOH+O2↑ D 2F2+2H2O=4HF+O2
10.在盛有稀H2SO4的烧杯中放入用导线连接锌片和铜片,下列叙述正确的是
A 正极附近的SO42―离子浓度逐渐增大
B 电子通过导线由铜片流向锌片
C 正极有O2逸出
D 铜片上有H2逸出
9.已知:①1 mol H2分子中化学键断裂时需要吸收436kJ的能量
②1 mol Cl2分子中化学键断裂时需要吸收243kJ的能量
③由H原子和Cl原子形成1 mol HCl分子时释放431kJ的能量
下列叙述正确的是
A.氢气和氯气反应生成氯化氢气体的热化学方程式是H2(g)+Cl2(g)=2HCl(g)
B.氢气和氯气反应生成2 mol氯化氢气体,反应的△H=183kJ/mol
C.氢气和氯气反应生成2 mol氯化氢气体,反应的△H=-183kJ/mol
D.氢气和氯气反应生成1 mol氯化氢气体,反应的△H=-183kJ/mol
8.能正确表示下列反应的离子方程式是
A 醋酸钠的水解反应 CH3COO-+H3O+=CH3COOH+H2O
B 碳酸氢钙与过量的NaOH溶液反应 Ca2++2HCO3-+2OH-=CaCO3↓+2H2O+CO32-
C 苯酚钠溶液与二氧化碳反应 C6H5O-+CO2+H2O=C6H5OH+CO32-
D 稀硝酸与过量的铁屑反应 3Fe+8H++2NO3-=3Fe3++2NO↑+4H2O
7.0.1mol/L NaHCO3溶液的pH最接近于
A.5.6 B.7.0 C.8.4 D.13.0
6.已知:C(s)+CO2(g)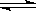 2CO(g)
△H>0。该反应的达到平衡后,下列条件有利于反应向正方向进行的是
2CO(g)
△H>0。该反应的达到平衡后,下列条件有利于反应向正方向进行的是
A 升高温度和减小压强 B 降低温度和减小压强
C 降低温度和增大压强 D 升高温度和增大压强
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com