
21、(10分)
以氯化钠和硫酸铵为原料制备氯化铵及副产品硫酸钠,工艺流程如下:
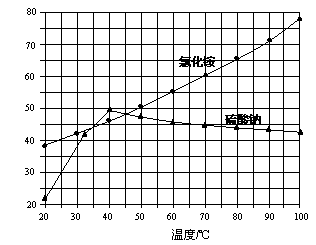
氯化铵和硫酸钠的溶解度随温度变化如上图所示。回答下列问题:
(1)欲制备10.7gNH4Cl,理论上需 NaCl g。
(2)实验室进行蒸发浓缩用到的主要仪器有 、烧杯、玻璃棒、酒精灯等。
(3)“冷却结晶”过程中,析出NH4Cl晶体的合适温度为 。
(4)不用其它试剂,检查NH4Cl产品是否纯净的方法及操作是 。
(5)若NH4Cl产品中含有硫酸钠杂质,进一步提纯产品的方法是 。
20、三氧化二镍(Ni2O3)可用于制造高能电池,其电解法制备过程如下:用NaOH调NiCl2溶液pH至7.5,加入适量硫酸钠后进行电解。电解过程中产生的Cl2在弱碱性条件下生成ClO-,把二价镍氧化为三价镍。以下说法正确的是
A、可用铁作阳极材料
B、电解过程中阳极附近溶液的pH升高
C、阳极反应方程式为: 2Cl- - 2e- = Cl2
D、1mol二价镍全部转化为三价镍时,外电路中通过了1mol电子。
第Ⅱ卷 非选择题(共80分)
19、下列说法正确的是
A、硫酸、纯碱、醋酸钠和生石灰分别属于酸、碱、盐和氧化物
B、蔗糖、硫酸钡和水分别属于非电解质、强电解质和弱电解质
C、Mg、Al、Cu可以分别用置换法、直接加热法和电解法冶炼得到
D、天然气、沼气和水煤气分别属于化石能源、可再生能源和二次能源
18、下述实验能达到预期目的的是
|
编号 |
实验内容 |
实验目的 |
|
A |
将SO2通入酸性KMnO4溶液中 |
证明SO2具有氧化性 |
|
B |
将Cl2通入NaBr溶液中 |
比较氯与溴的氧化性强弱 |
|
C |
将铜与浓硝酸反应生成的气体收集后用冰水混合物冷却降温 |
研究温度对化学平衡的影响 |
|
D |
分别向2支试管中加入相同体积不同浓度的H2O2溶液,再向其中1支加入少量MnO2 |
研究催化剂对H2O2分解速率的影响 |
17、短周期元素X、Y、Z的原子序数依次递增,其原子的最外层电子数之和为13。X与Y、Z位于相邻周期,Z原子最外层电子数是X原子内层电子数的3倍或者Y原子最外层电子数的3倍。下列说法正确的是
A、X的氢化物溶于水显酸性
B、Y的氧化物是离子化合物
C、Z的氢化物的水溶液在空气中存放不易变质
D、X和Z的最高价氧化物对应的水化物都是弱酸
16、灰锡(以粉末状存在)和白锡是锡的两种同素异形体。已知:
① Sn(s、白) + 2HCl(aq)= SnCl2(aq)+ H2(g) △H1
② Sn(s、灰) + 2HCl(aq)= SnCl2(aq)+ H2(g) △H2




|
下列说法正确的是
A、△H1 >△H2
B、锡在常温下以灰锡状态存在
C、灰锡转化为白锡的反应是放热反应
D、锡制器皿长期处于低于13.2℃的环境中,会自行毁坏
15、下列各溶液中,微粒的物质的量浓度关系正确的是
A、1.0mol·LNa2CO3溶液:c(OH-) = c(HCO3-) + c(H+) + 2c(H2CO3)
B、1.0mol·LNH4Cl溶液:c(NH4+) = c(Cl-)
C、向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液:
c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
D、向硝酸钠溶液中滴加稀盐酸得到的pH=5的混合溶液:c(Na+)=c(NO3-)
14、
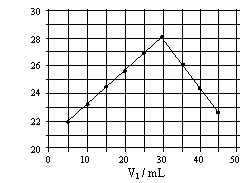 将V1mL1.00mol·L-1 HCl溶液和V2mL未知浓度的
将V1mL1.00mol·L-1 HCl溶液和V2mL未知浓度的
NaOH溶液混合均匀后测量并记录溶液温度,实验
结果如右图所示(实验中始终保持 V1 + V2= 50mL)。
下列叙述正确的是
A、做该实验时环境温度为22℃
B、该实验表明化学能可能转化为热能
C、NaOH溶液的浓度约为1.0mol/L
D、该实验表明有水生成的反应都是放热反应
13、顺式Pt(NH3)2Cl2(式量为300)是临床广泛使用的搞肿瘤药物。下列有关该物质的说法中正确的是
A、由4种元素组成 B、含有NH3分子
C、Pt的化合价为+4 D、Pt元素的质量百分含量为65%
12、为了避免青铜器生成铜绿,以下方法正确的是
A、将青铜器放在银质托盘上; B、将青铜器保存在干燥的环境中
C、将青铜器保存在潮湿的空气中; D、在青铜器的表面覆盖一层防渗的高分子膜
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com