
7.下列叙述正确的是
A.相同条件下,M2和O2的混合气体与等休整的N2所含原子数相等
B.等物质的量的甲基(-OH2)与羟基(-OH)所含电子数相等
C.常温常压下28 g CO与22.4 L O2所含分子数相等
D.16 g CH2与19 g NH+4所含质子数相等
6.题6表是食用碘盐包装上的部分说明,下列说法正确的是
A.高温会导致碘的损失
B.碘酸钾可氧化氯化钾
C.可用淀粉检验碘盐中的碘酸钾
D.该碘盐中碘酸钾含量为20~50 mg/kg
题6表
|
配料 |
精盐、碘酸钾、抗结剂 |
|
碘含量 |
35±15 mg/kg |
|
储存方法 |
密封、避光、防潮 |
|
食用方法 |
烹饪时,待食品熟后加入碘盐 |
29、(10分)
C、Si、Ge、Sn是同族元素,该族元素单质及其化合物在材料、医药等方面有重要应用。请回答下列问题:
(1) Ge的原子核外电子排布式为
(2) C、Si、Sn三种元素的单质中,能够形成金属晶体的是
(3) 按要求指出下列氧化物的空间构型、成键方式或性质
①CO2分子的空间构型及碳氧之间的成键方式 ;
②SiO2晶体的空间构型及硅氧之间的成键方式 ;
③已知SnO2是离子晶体,写出其主要物理性质 (写出2条即可)
(4) CO可以和很多金属形成配合物,如Ni(CO)4,Ni与CO之间的键型为
(5) 碳氧键的红外伸缩振动频率与键的强度成正比,已知Ni(CO)4中碳氧键的伸缩振动频率为2060cm-1,CO分子中碳氧键的伸缩振动频率为2143cm-1,则Ni(CO)4中碳氧键的强度比CO分子中碳氧键的强度 (填字母)
A、强 B、弱 C、相等 D、无法判断
28、(10分)
已知苯甲醛在一定条件下可以通过Perkin反应生成肉桂酸(产率45~50%),另一个产物A也呈酸性,反应方程式如下:
C6H5CHO + (CH3CO)2O → C6H5CH=CHCOOH + A
苯甲醛 肉桂酸
(1)Perkin反应合成肉桂酸的反应式中,反应物的物质的量之比为1 :1。产物A的名称是 。
(2)一定条件下,肉桂酸与乙醇反应生成香料肉桂酸乙酯,其反应方程式为
(不要求标出反应条件)
(3)取代苯甲醛也能发生Perkin反应,相应产物的产率如下:
|
取代苯甲醛 |
 |
|
|
|
|
产率(%) |
15 |
23 |
33 |
0 |
|
取代苯甲醛 |
 |
|
|
|
|
产率(%) |
71 |
63 |
52 |
82 |
可见,取代基对Perkin反应的影响有(写出3条即可):
①
②
③
(4)溴苯(C6H5Br)与丙烯酸乙酯(CH2CHCOOC2H5)在氯化钯催化下可直接合成肉桂酸乙酯,该反应属于Beck反应,是芳香环上的一种取代反应,其反应方程式为
(不要求标出反应条件)
(5)Beck反应中,为了促进反应的进行,通常可加入一种显 (填字母)的物质
A、弱酸性 B、弱碱性 C、中性 D、强酸性
27、(9分)
克矽平是一种治疗矽肺病的药物,其合成路线如下(反应均在一定条件下进行):

(1)化合物Ⅰ的某些性质类似苯。例如,化合物Ⅰ可以一定条件下与氢气发生加成反应生成

,其反应方程式为 (不要求标出反应条件)
(2)化合物I生成化合物Ⅱ是原子利用率100%的反应,所需另一种反应物的分子式为
(3)下列关于化合物和化合物Ⅲ的化学性质,说法正确的是 (填字母)
A、化合物Ⅲ可以与CH3COOH发生酯化反应
B、化合物Ⅲ不可以与金属钠生成氢气
C、化合物Ⅲ可以使溴的四氯化碳溶液褪色
D、化合物Ⅲ不可以使酸性高锰酸钾溶液褪色
(4)化合物Ⅲ生成化合物Ⅳ的反应方程式为 (不要求标出反应条件)
(5)用氧化剂氧化化合物Ⅳ生成克矽平和水,则该氧化剂为 。
26、(12分)
羟基磷灰石[Ca5(PO4)3OH]是一种一种重要的生物无机材料。其常用的制备方法有两种:
方法A:用浓氨水分别调Ca(NO3)2和(NH4)2HPO4溶液的pH约为12;在剧烈搅拌下,将(NH4)2HPO4溶液缓慢滴入Ca(NO3)2溶液中。

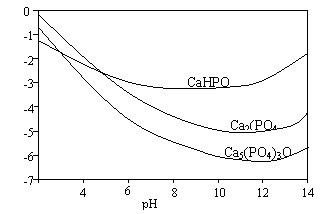 方法B:剧烈搅拌下,将H3PO4溶液缓慢滴加到Ca(OH)2悬浊液中。
方法B:剧烈搅拌下,将H3PO4溶液缓慢滴加到Ca(OH)2悬浊液中。
3种钙盐的溶解度随溶液pH的变化如上图所示(图中纵坐标是钙离子浓度的对数),回答下列问题:
(1)完成方法A和方法B中制备Ca2(PO4)3OH的化学反应方程式:
①5 Ca(NO3)2 + 3(NH4)2HPO4 + 4NH3·H2O = Ca5(PO4)3OH↓+ +
②5Ca(OH)2 + 3H3PO4 =
(2)与方法A相比,方法B的优点是 。
(3)方法B中,如果H3PO4溶液滴加过快,制得的产物不纯,其原因是
。
(4)图中所示3种钙盐在人体中最稳定的存在形式是 (填化学式)。
(5)糖沾附在牙齿上,在酶的作用下产生酸性物质,易造成龋齿。结合化学平衡移动原理,分析其原因 。
25、(10分)
黄铁矿(主要成分为FeS2)是工业制取硫酸的重要原料,其煅烧产物为SO2和Fe3O4。
(1)将0.050molSO2(g)和0.030molO2(g)放入容积为1L的密闭容器中,反应:
2SO2(g) + O2(g) 
 2SO3(g)在一定条件下达到平衡,测得c(SO3)=0.040mol·L。计算该条件下反应的平衡常数K和SO2的平衡转化率(写出计算过程)。
2SO3(g)在一定条件下达到平衡,测得c(SO3)=0.040mol·L。计算该条件下反应的平衡常数K和SO2的平衡转化率(写出计算过程)。
(2)已知上述反应是放热反应,当该反应处于平衡状态时,在体积不变的条件下,下列措施中有利于提高SO2平衡转化率的有 (填字母)
A、升高温度 B、降低温度 C、增大压强
D、减小压强 E、加入催化剂 G、移出氧气
(3)SO2尾气用饱和Na2SO3溶液吸收可得到更要的化工原料,反应的化学方程式为
。
(4)将黄铁矿的煅烧产物Fe3O4溶于H2SO4后,加入铁粉,可制备FeSO4。酸溶过程中需保持溶液足够酸性,其原因是 。
24、(10分)
二氧化锰是制造锌锰干电池的基本材料。工业上以软锰矿为原料,利用硫酸亚铁制备高纯二氧化锰的流程如下:

某软锰矿的主要成分为MnO2,还含有Si(16.27%)、Fe(5.86%)、Al(3.42%)、Zn(2.68%)和Cu(0.86%)等元素的化合物。部分阳离子以氢氧化物或硫化物的形式完全沉淀时溶液的pH见下表,回答下列问题:
|
沉淀物 |
Al(OH)3 |
Fe(OH)3 |
Fe(OH)2 |
Mn(OH)2 |
Cu(OH)2 |
Zn(OH)2 |
CuS |
ZnS |
MnS |
FeS |
|
pH |
5.2 |
3.2 |
9.7 |
10.4 |
6.7 |
8.0 |
≥-0.42 |
≥2.5 |
≥7 |
≥7 |
(1)硫酸亚铁在酸性条件下将MnO2还原为MnSO4,酸浸时发生的主要反应的化学方程式为 。
(2)滤渣A的主要成分是 。
(3)加入MnS的目的是除去 杂质。
(4)碱性锌锰电池中,MnO2参与的电极反应方程式为 。
(5)从废旧碱性锌锰电池中可以回收利用的物质有 (写两种)。
23、(11分)
已知某混合金属粉末,除铝外还含有铁、铜中的一种或两种,所含金属的量都在5%以上。请设计合理实验探究该混合物金属粉末中铁、铜元素的存在。
仅限选择的仪器和试剂:烧杯、试管、玻璃棒、量筒、容量瓶、滴管、药匙;1mol·L硫酸、2mol·L硝酸、2mol·LNaOH溶液、20%KSCN溶液。
完成以下实验探究过程:
(1)提出假设:
假设1 该混合金属粉末中除铝外还含有 元素;
假设2 该混合金属粉末中除铝外还含有 元素;
假设1 该混合金属粉末中除铝外还含有Fe、Cu元素;
(2)设计实验方案
基于假设3,设计出实验方案(不要在答题卡上作答)。
(3)实验过程
根据(2)的实验方案,叙述实验操作、预期现象和结论。
[提示]Ⅰ.在答题卡上按以下方式作答,注意前后内容对应;
Ⅱ.注意文字简洁,确保不超过答题卡空间。
|
编号 |
实验操作 |
预期现象和结论 |
|
① |
|
|
|
② |
|
|
|
③ |
|
|
|
④ |
|
|
|
|
|
|
22、(8分)
“碘钟”实验中,3I- + S2O32- = I3- + 2SO42-的反应速率可以用I3-与加入的淀粉溶液显蓝色的时间t来度量,t越小,反应速率越大。某探究性学习小组在20℃进行实验,得到的 数据如下表:
|
实验编号 |
① |
② |
③ |
④ |
⑤ |
|
c(I-)/mol·L- |
0.040 |
0.080 |
0.080 |
0.160 |
0.120 |
|
c(SO42-)/mol·L- |
0.040 |
0.040 |
0.080 |
0.020 |
0.040 |
|
t /s |
88.0 |
44.0 |
22.0 |
44.0 |
t2 |
回答下列问题:
(1)该实验的目的是 。
(2)显色时间t2= .
(3)温度对该反应的反应速率的影响符合一般规律,若在40℃下进行编号③对应浓度的实验,显色时间t2的范围为 (填字母)
A、<22.0s B、22.0~44.0s C、>44.0s D、数据不足,无法判断
(4)通过分析比较上表数据,得到的结论是 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com