
29.(14分)a、b、c、d、e是短周期元素,周期表中a与b、b与c相邻;a与c的最外层电子数之比为2∶3,b的最外层电子数比c的最外层电子数少1个;常见化合物d2c2与水反应生成c的单质,且溶液使酚酞试液变红.
(1)e的元素符号是 .
(2)a、b、c的氢化物稳定性顺序为(用分子式表示) ;b的氢化物和b的最高价氧化物的水化物反应生成Z,则Z中的化学键类型为 ,Z的晶体类型为 ;ab-离子的电子式为 .
(3)由a、c、d形成化合物的水溶液显碱性,其原因是(用离子方程式表示) .
(4)一定量的d2c2与ac2反应后的固体物质,恰好与0.8 mol稀盐酸溶液完全反应,并收集到0.25 mol气体,则用物质的量表示该固体物质的组成为 .
28.(16分)有机物A、B、C互为同分异构体,分子式为C5H8O2,有关的转化关系如题28图所示,已知:A的碳链无支链,且1 mol A 能与4 mol Ag(NH3)2OH完全反应;B为五元环酯.
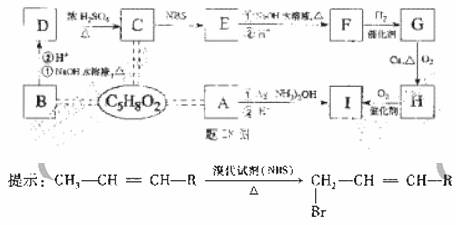
提示:
(1)A中所含官能团是 .
(2)B、H结构简式为 .
(3)写出下列反应方程式(有机物用结构简式表示)
E→C ;
E→F .
(4)F的加聚产物的结构简式为 .
27.(16分)某兴趣小组设计出题27图所示装置来改进教材中“铜与硝酸反应”实验,以探究化学实验的绿色化.
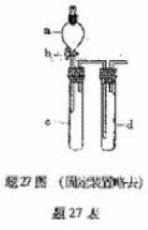
(1)实验前,关闭活塞b,试管d中加水至浸没长导管口,塞紧试管c和d的胶塞,加热c.其目的是 .
(2)在d中加适量NaOH溶液,c中放一小块铜片,由分液漏斗a向c中加入2 mL浓硝酸.c中反应的化学方程式是 .再由a向e中加2 mL蒸馏水,c中的实验现象是 .
(3)题27表是制取硝酸铜的三种方案,能体现绿色化学理念的最佳方案是 .
再由a向c中加2 mL蒸馏水,c中的实验现象是 .
(4)该小组还用上述装置进行实验证明氧化性KMnO4>Cl2>Br2.操作步骤为 ,
实验现象为 ;但此实验的不足之处是 .
26.(14分)脱除天然气中的硫化氢既能减少环境污染,又可回收硫资源.
(1)硫化氢与FeCl3溶液反应生成单质硫,其离子方程式为 .
(2)用过量NaOH溶液吸收硫化氢后,以石墨作电极电解该溶液可回收硫、其电解总反应方程式(忽略氧的氧化还原)为 ;该方法的优点是 .
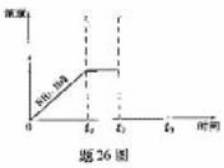
(3)一定温度下1 mol NH4 HS固体在定容真空容器中可部分分解为硫化氢和氨气.
①当反应达平衡时ρ氨气×p硫化氢=a(Pa2),则容器中的总压为 Pa;
②题26图是上述反应过程中生成物浓度随时间变化的示意图.若t2时增大氨气的浓度且在t3时反应再次达到平衡,诸在图上画出t2时刻后氨气、硫化氢的浓度随时间的变化曲线.
|
方案 |
反应物 |
|
甲 |
Cu、浓HNO3 |
|
乙 |
Cu、稀HNO3 |
|
丙 |
Cu、O2、稀HNO3 |
13.已知1 g氢气完全燃烧生成水蒸气时放出热量121 kJ.且氧气中1 mol O=O键完全断裂时吸收热量496 Kj,水蒸气中1 mol H-O键形成时放出热量463 Kj,则氢气中1 mol H-H键断裂时吸收热量为
A.920 kJ B.557 kJ
C. 436 kJ D.188 kJ
12.用过量的H2SO4、NaOH、NH3、H2O、NaCl等溶液,按题12图所示步骤分开五种离子.则溶液①、②、③、④是
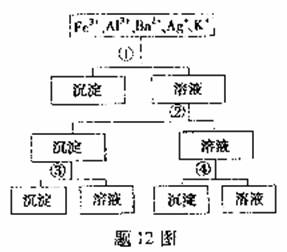
A. ①NaCl ②NaOH ③NH2·H2O ④H2SO4
B. ①H2SO4 ②NaOH ③NH3·H2O ④NaCl
C. ①H2SO4 ②NH3·H2O ③NaOH ④NaCl
D. ①NaCl ②NH3·H2O ③NaOH ④H2SO4
11.如题11图所示,下列叙述正确的是
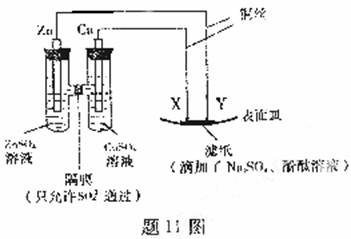
A.Y为阴极,发生还原反应
B.X为正极,发生氧化反应
C.Y与滤纸接触处有氧气生成
D.X为滤纸接触处变红
10.用食用白醋(醋酸浓度约1 mol/L)进行下列实验,能证明醋酸为弱电解质的是
A.白醋中滴入石蕊试液呈红色
B.白醋加入豆浆中有沉淀产生
C.蛋壳浸泡在白醋中有气体放出
D.pH试纸显示白醋的pH为2~3
9.氧氟沙星是常用抗菌药,其结构简式如题9图所示,下列对氧氟沙星叙述错误的是
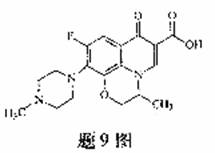
A.酸发生加成、取代反应
B.能发生还原、酯化反应
C.分子内共有19个氢原子
D.分子内共平面的碳原子多于6个
8.对下列反应①NHCO,溶液与石灰水反应、②Kn2SO2溶液与稀盐酸反应、③Si与烧碱溶液反应、④Fe与稀硝酸反应,改变反应物用量,不能用同一个离子方程式表示的是
A. ①②③ B. ①②④ C. ①③④ D. ②③④
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com