
17.(10分)
实验室常利用甲醛法测定(NH )
) S0
S0 样品中氮的质量分数,其反应原理为:4NH
样品中氮的质量分数,其反应原理为:4NH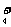 +6HCHO
+6HCHO 3H
3H +6H
+6H 0+(CH
0+(CH )
)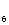 N
N H
H [滴定时,1 mol(CH
[滴定时,1 mol(CH )
)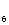 N
N H
H 与1 mol H
与1 mol H 相当],然后用NaOH标准溶液滴定反应生成的酸。某兴趣小组用甲醛法进行了如下实验:
相当],然后用NaOH标准溶液滴定反应生成的酸。某兴趣小组用甲醛法进行了如下实验:
步骤I 称取样品1.500 g。
步骤Ⅱ 将样品溶解后,完全转移到250mL容量瓶中,定容,充分摇匀。
步骤Ⅲ 移取25.00 mL样品溶液于250 mL锥形瓶中,加入10 mL20%的中性甲醛溶液,摇匀、静置5 min后,加入l-2滴酚酞试液,用NaOH标准溶液滴定至终点。按上述操作方法再重复2次。
(1)根据步骤Ⅲ填空:
①碱式滴定管用蒸馏水洗涤后,直接加入NaOH标准溶液进行滴定,则测得样品中氮的质量分数 ▲ (填“偏高”、“偏低”或“无影响”)。
②锥形瓶用蒸馏水洗涤后,水未倒尽,则滴定时用去NaOH标准溶液的体积 ▲ (填“偏大”、“偏小”或“无影响”)。
③滴定时边滴边摇动锥形瓶,眼睛应观察 ▲ 。
A.滴定管内液面的变化 B.锥形瓶内溶液颜色的变化
④滴定达到终点时,酚酞指示剂由 ▲ 色变成 ▲ 色。
(2)滴定结果如下表所示:
|
滴定次数 |
待测溶液的体积 /mL |
标准溶液的体积 |
|
|
滴定前刻度/mL |
滴定后刻度/mL |
||
|
1 |
25.00 |
1.02 |
21.03 |
|
2 |
25.00 |
2.00 |
21.99 |
|
3 |
25.00 |
0.20 |
20.20 |
若NaOH标准溶液的浓度为0.1010 mol·L-1,则该样品中氮的质量分数为 ▲ 。
16.某合金(仅含铜、铁)中铜和铁的物质的量之和为ymol,其中Cu的物质的量分数为a,将其全部投入50 mLb
mol·L 的硝酸溶液中,加热使其充分反应(假设NO是唯一的还原产物)。下列说法正确的是
的硝酸溶液中,加热使其充分反应(假设NO是唯一的还原产物)。下列说法正确的是
A.若金属有剩余,在溶液中再滴人硫酸后,金属又开始溶解
B.若金属全部溶解,则溶液中一定含有Fe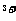
C.若金属全部溶解,且产生336 mL气体(标准状况),则b=0.3
D.当溶液中金属离子只有Fe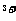 、Cu
、Cu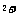 时,则a与b的关系为:b≥80y(1一
时,则a与b的关系为:b≥80y(1一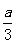 )
)
15.下列溶液中各微粒的浓度关系不正确的是
A.0.1 mol·L HCOOH溶液中:c(HC00
HCOOH溶液中:c(HC00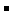 )+
c(OH
)+
c(OH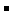 ):c(H
):c(H )
)
B.1 L O.1.mol·L CuS0
CuS0 ·(NH
·(NH )
) S0
S0 ·6H
·6H 0的溶液中:
0的溶液中:
c(SO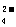 )> c(NH
)> c(NH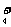 )> c(Cu
)> c(Cu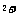 )> c(H
)> c(H )> c(OH
)> c(OH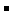 )
)
C.0.1 mol·L NaHCO
NaHCO 溶液中:
溶液中:
c(Na )+c(H
)+c(H )+
c(H
)+
c(H CO
CO )
) c(HCO
c(HCO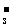 )+
c(C0
)+
c(C0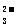 )+
c(OH
)+
c(OH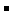 )
)
D.等体积、等物质的量浓度的NaX和弱酸HX混合后的溶液中:
c(Na )> c(HX)> c(x
)> c(HX)> c(x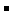 )> c(H
)> c(H )> c(OH
)> c(OH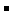 )
)
14.有X、Y两种元素,原子序数≤20,X的原子半径小于Y,且X、Y原子的最外层电子数相同(选项中m、n均为正整数)。下列说法正确的是
A.若X(OH) 为强碱,则Y(0H)
为强碱,则Y(0H) 也一定为强碱
也一定为强碱
B.若H X0
X0 为强酸,则X的氢化物溶于水一定显酸性
为强酸,则X的氢化物溶于水一定显酸性
C.若X元素形成的单质是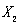 ,则Y元素形成的单质一定是Y
,则Y元素形成的单质一定是Y
D.若Y的最高正价为+m,则X的最高正价一定为+m
13. 一定温度下可逆反应:A(s)+2B(g)2C(g)+D(g);△H<0。现将1 mol A和2 mol B加入甲容器中,将4 mol C和2 mol D加入乙容器中,此时控制活塞P,使乙的容积为甲的2倍,
一定温度下可逆反应:A(s)+2B(g)2C(g)+D(g);△H<0。现将1 mol A和2 mol B加入甲容器中,将4 mol C和2 mol D加入乙容器中,此时控制活塞P,使乙的容积为甲的2倍,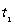 时两容器内均达到平衡状态(如图1所示,隔板K不能移动)。下列说法正确的是
时两容器内均达到平衡状态(如图1所示,隔板K不能移动)。下列说法正确的是

A.保持温度和活塞位置不变,在甲中再加入1 molA和2molB,达到新的平衡后,甲中C的浓度是乙中C的浓度的2倍
B.保持活塞位置不变,升高温度,达到新的平衡后,甲、乙中B的体积分数均增大
C.保持温度不变,移动活塞P,使乙的容积和甲相等,达到新的平衡后,乙中C的体积分数是甲中C的体积分数的2倍
D.保持温度和乙中的压强不变, 时分别向甲、乙中加入等质量的氦气后,甲、乙中反应速率变化情况分别如图2和图3所示(
时分别向甲、乙中加入等质量的氦气后,甲、乙中反应速率变化情况分别如图2和图3所示( 前的反应速率变化已省略)
前的反应速率变化已省略)
12.花青苷是引起花果呈现颜色的一种花色素,广泛存在于植物中。它的主要结构在不同pH条件下有以下存在形式:
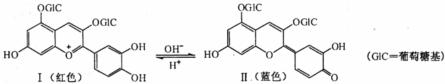
下列有关花青苷说法不正确的是
A.花青苷可作为一种酸碱指示剂
B.I和Ⅱ中均含有二个苯环
C.I和Ⅱ中除了葡萄糖基外,所有碳原子可能共平面
D.I和Ⅱ均能与FeCl3溶液发生显色反应
11.某同学按右图所示的装置进行电解实验。下列说法正确的是
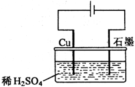 A.电解过程中,铜电极上有H2产生
A.电解过程中,铜电极上有H2产生
B.电解初期,主反应方程式为: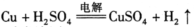
C.电解一定时间后,石墨电极上有铜析出
D.整个电解过程中,H+的浓度不断增大
10.用下列实验装置完成对应的实验(部分仪器已省略),能达到实验目的的是
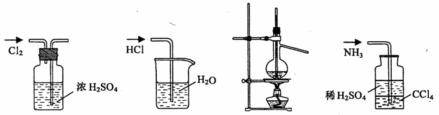
A.干燥Cl2 B.吸收HCl C.石油的蒸馏 D.吸收NH3
9.下列离子方程式书写正确的是
A.过量的S02通入NaOH溶液中:SO2+2OH-1 SO32-+H2O
SO32-+H2O
B.Fe(NO3)3溶液中加入过量的HI溶液:2Fe3++2I- 2Fe2++I
2Fe2++I
C.NaNO2溶液中加入酸性KMnO 溶液:2Mn4-:+5NO2-;+6H+
溶液:2Mn4-:+5NO2-;+6H+ 2Mn2++5NO3-+3H2O
2Mn2++5NO3-+3H2O
D.NaHCO3溶液中加入过量的Ba(OH)2:溶液:
2HCO3-+Ba2++2OH- BaCO3↓+2H2O+CO32-
BaCO3↓+2H2O+CO32-
8.阿伏加德罗常数约为6.02×1023 mol-1 ,下列叙述正确的是
A.2.24LCO2中含有的原子数为0.3×6.02×1023
B.0.1 L 3mol·L-1的NH4NO3溶液中含有的NH4+数目为0.3×6.02×l023
C.5.6 g铁粉与硝酸反应失去的电子数一定为0.3×6.02×1023
D.4.5 gSiO2晶体中含有的硅氧键数目为0.3×6.02×1023
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com