
6.下列叙述中正确的是
A.用标准NaOH溶液滴定未知浓度的盐酸,用去23.10 mL NaOH溶液
B.用pH试纸测得溶液的pH是3.5
C.滴定管用蒸馏水洗净后注入标准液,会使测定结果偏低
D.滴定前仰视读数, 滴定后俯视读数, 会使测定结果偏高
5.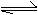 酸碱指示剂(HIn)在水溶液中存在以下电离平衡:HIn(红色) H++In-(黄色)。请判断下列溶液:①盐酸 ②澄清石灰水 ③氯化铵溶液 ④硫酸氢钠溶液 ⑤亚硫酸氢铵溶液
酸碱指示剂(HIn)在水溶液中存在以下电离平衡:HIn(红色) H++In-(黄色)。请判断下列溶液:①盐酸 ②澄清石灰水 ③氯化铵溶液 ④硫酸氢钠溶液 ⑤亚硫酸氢铵溶液
⑥磷酸氢二钠溶液 其中能使指示剂显红色的是
A.①④⑥ B.①②⑤⑥
C.①③④⑤ D.②③⑤
4.对下列事实解释错误的是
A.向蔗糖中加入浓硫酸后出现发黑现象,说明浓硫酸具有脱水性
B.浓硝酸在光照下颜色变黄,说明浓硝酸不稳定
C.常温下,浓硝酸可以用铝罐贮存,说明铝与浓硝酸不反应
D.浓盐酸敞口放置酸性减弱,说明浓盐酸易挥发
3.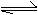 已知:CH3COOH CH3COO-+H+,K为其电离平衡常数,则下列说法错误的是
已知:CH3COOH CH3COO-+H+,K为其电离平衡常数,则下列说法错误的是
A.K只与温度有关,温度升高,K值增大
B. K值越大,酸性越强
C.其表达式为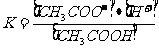
D.加入少量CH3COONa固体,K值增大
2.下列叙述正确的是
A.在潮湿的空气中能形成白雾的气态氢化物一定是氯化氢
B.合金由金属与金属共同组成,其性能优于纯金属
C.常温下硅可以与氟气、强碱溶液起反应,在加热条件下可在氧气中燃烧
D.溴水放在带橡胶塞的试剂瓶中
1.据统计,世界上的古建筑在20世纪所遭受的腐蚀比过去几百年甚至几千年所遭受的腐蚀还要严重,这是因为
A.古建筑的腐蚀是可逆过程,在几百年前甚至几千年前处于化学平衡状态,而近几十年来腐蚀向正反应方向移动
B.由于近几十年来大量使用矿石燃料,造成酸雨形成,加速了古建筑的腐蚀
C.由于近几十年来参观的人数急剧增多,加速了古建筑的磨损
D.由于近几十年来温室效应加剧,加速了古建筑的风化
16.(16分)已知,在1273K时可逆反应: 的平衡常数K=1.5;现在容积为2.0L的密闭容器中进行该反应,试解答下列问题:
的平衡常数K=1.5;现在容积为2.0L的密闭容器中进行该反应,试解答下列问题:
(1)写出该反应的平衡常数表达式:
(2)若生成2.00mol 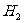 ,至少需通入水蒸气物质的量为______________
,至少需通入水蒸气物质的量为______________
(3)若向上述密闭容器中投入0.80mol还原铁粉,充入水蒸气至浓度为0.50mo1·L ,加热到1273K。
,加热到1273K。
①当反应进行到c[H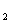 O(g)]=0.25 mo1·L
O(g)]=0.25 mo1·L ,试判断该反应是否达到平衡?简述判断依据。
,试判断该反应是否达到平衡?简述判断依据。
②当反应达到平衡后,求密闭容器中H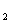 O(g)的物质的量。
O(g)的物质的量。
15.(12分)某温度时,在固定容积为2 L的密闭容器中X、Y、Z三种气体物质的量随时间的变化曲线如右图所示。请回答:
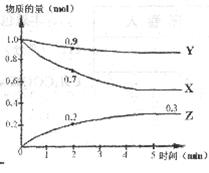
(1)该反应的化学方程式为__________________________
(2)该反应达到平衡的时间是在反应进行了约________________min时。
(3)反应开始至2 min,Z的平均反应速率为________________________
(4)若开始时向容器中加入X、Y各2 mol,试判断平衡时Z的物质的量[n(Z)]大于________mol。
(5)下列各项可作为该反应达到平衡状态的标志的是__________(填各项代号)。
A.体系的质量不再变化 B.气体密度不再变化
C.容器的压强不再变化 D.气体平均式量不再变化
14.(16分)Ⅰ.现有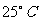 、Ph=13的
、Ph=13的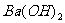 溶液。
溶液。
(1)该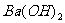 溶液的物质的量浓度为________________
溶液的物质的量浓度为________________
(2)加水稀释l00倍,所得溶液中由水电离出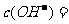 _____________
_____________
(3)与Ph=13的NaOH溶液按体积比l︰4混合,所得溶液的pH=_______________
(4)与pH=10的NaOH溶液等体积混合,所得溶液中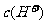 约为_________________
约为_________________
(5)与某浓度盐酸溶液按体积比(碱与酸之比)1︰9混合后,所得溶液pH=11,该盐酸溶液的pH=_____________
Ⅱ.在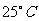 时,某强酸溶液的pH=a,强碱溶液的pH=b,且酸碱混合后的溶液pH=7。请回答下列问题:
时,某强酸溶液的pH=a,强碱溶液的pH=b,且酸碱混合后的溶液pH=7。请回答下列问题:
(1)酸溶液的体积[V(酸)]与碱溶液的体积[V(碱)]的关系为_______________
(2)若酸溶液与碱溶液的体积比为10︰1,则a与b的关系为_______________
(3)若a+b=12,则酸溶液中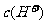 与碱溶液中
与碱溶液中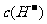 的关系为___________
的关系为___________
13.(13分)盖斯是热化学的奠基人,于l840年提出盖斯定律,解决了不能直接发生的反应其反应热的确定问题。

(1)已知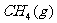 、
、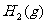 、
、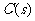 在
在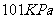 下燃烧的热化学方程式分别为:
下燃烧的热化学方程式分别为:
①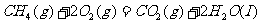 ,
,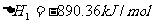
②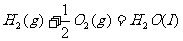 ,
,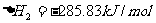
③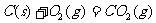 ,
,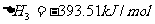
则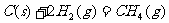 的
的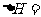 _______________________-----
_______________________-----
(2)工业上高纯硅通过下列反应制取: 。
。
已知部分化学键键能如下表。
|
化学键 |
Si-O |
Si-Cl |
H-H |
H-Cl |
Si-Si |
Si-C |
|
键能(KJ/mol) |
460 |
360 |
436 |
431 |
176 |
347 |
则上述反应的反应热△H=______________________。
(3)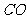 、
、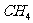 均为常见的可燃性气体。
均为常见的可燃性气体。
①已知在101kPa时,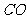 的燃烧热为283kJ/mol。相同条件下,若2molCH
的燃烧热为283kJ/mol。相同条件下,若2molCH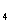 完全燃烧生成液态水,所放出的热量约为l mol
完全燃烧生成液态水,所放出的热量约为l mol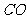 完全燃烧放出热量的6倍,CH
完全燃烧放出热量的6倍,CH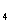 完全燃烧反应的热化学方程式是____________。
完全燃烧反应的热化学方程式是____________。
②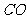 和CH
和CH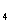 的混合气体共112L(标况),在足量的空气中完全燃烧时放出热量3113KJ,求混合气体中
的混合气体共112L(标况),在足量的空气中完全燃烧时放出热量3113KJ,求混合气体中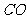 与CH
与CH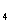 的体积比为___________________。
的体积比为___________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com