
9.下列分子或离子中都存在着配位键的一组是
A.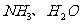
B.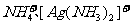
C.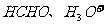
D.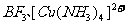
8.下列说法不正确的是
A.同主族元素,随着电子层数的增加,第一电离能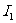 逐渐增大
逐渐增大
B.同周期元素,随着原子序数的增加,第一电离能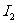 呈增大趋势
呈增大趋势
C.通常情况下,电离能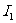 <
<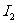 <
<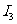
D.电离能越小,元素的金属性越强
7.第三周期元素的原子,其最外电子层P亚层上有一个未成对电子,它的最高价氧化物对应水化物的酸根离子是
A.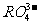 B.
B.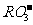 C.
C.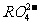 D.
D.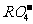
6.下列元素原子半径依次增大的是
A.C、N、O、F B.Mg、Al、Si、S
C.B、Be、Mg、Na D.Mg、Na、K、Ca
5.元素的性质呈现周期性变化的根本原因是
A.原子半径呈现周期性变化
B.元素的第一电离能呈现周期性变化
C.元素的电负性呈现周期性变化
D.元素原子的核外电子排布呈现周期性变化
4.下列各组元素按电负性由大到小排列正确的是
A.Cl>S>As B.O>C1>F
C.As>P>H D.F>N>O
3.下列轨道表示式所表示的元素原子中,其能量处于最低状态的是
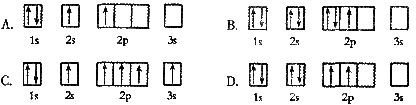
2.以下能级符号不正确的是
A.5S B.3f C.6p D.4d
1.下列叙述中,不属于核外电子的特点的是
A.质量很小 B.运动范围很小
C.运动速率很快 D.有确定的运动轨道
27.由HCl 、MgCl2 、AlCl3组成的混合溶液1.0L,其中c(HCl)=0.1 mol·L-1 c(MgCl2)=0.1 mol·L-1 c(AlCl3)=1.2 mol·L-1。溶液中c(Mg2+)与溶液pH的关系为lg c(Mg2+)=17-2 pH。已知向溶液中加入NaOH固体,溶液中C([Al(OH)4]- )随pH变化如下:
|
pH |
8 |
9 |
10 |
11 |
|
C([Al(OH)4]- ) mol·L-1 |
10-3 |
10-2 |
10-1 |
1 |
(1)向混合溶液中加入NaOH固体至pH=10时,是否有Mg(OH)2沉淀出现?___________(填“是”或“否”)(不考虑NaOH的加入引起的体积变化),原因是_____________________。
(2)请仔细观察表中数据计算,当向混合溶液中加入NaOH固体至pH=11时,需NaOH的质量是多少?(当溶液中某离子的浓度≤1×10-5 mol·L-1 时,可视为该离子沉淀完全)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com