
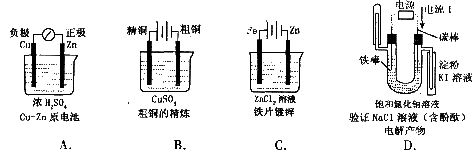
2.下列有关电化学的图示,完全正确的是
1.在pH=1的无色溶液中能大量共存的离子组是
A.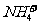 、
、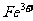 、
、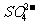 、
、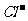 B.
B.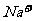 、
、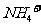 、
、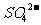 、
、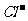
C.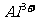 、
、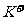 、
、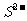 、
、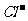 D.
D.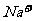 、
、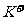 、
、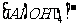 、
、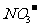
27.(10分)下表是元素周期表的一部分,表中所列的字母分别代表某一化学元素。
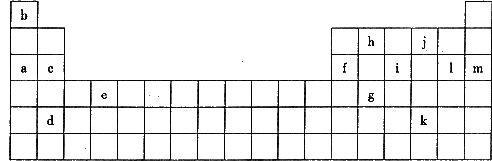
请填写下列空白:
(1)下列_______(填写编号)组元素的单质可能都是电的良导体。
①a、c、h ②b、g、k ③c、h、l ④d、e、f
(2)如果给核外电子足够的能量,这些电子便会摆脱原子核的束缚而离去。核外电子离开该原子或离子所需要的能量主要受两大因素的影响。
原子核失去核外不同电子所需的能量(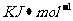 ):
):
|
|
锂 |
X |
Y |
|
失去第一个电子 |
519 |
502 |
580 |
|
失去第二个电子 |
7296 |
4570 |
1820 |
|
失去第三个电子 |
11799 |
6920 |
2750 |
|
失去第四个电子 |
|
9550 |
11600 |
①通过上述信息和表中的数据分析,为什么锂原子失去核外第二个电子时所需的能量要远远大于失去第一个电子所需的能量_________________________________________________;
②表中X可能为以上l3种元素中的________(填写字母)元素;
③Y是周期表中___________族的元素;
④以上13种元素中,___________(填写字母)元素原子第一电离能最大。
26.(8分)现有下列短周期元素性质的数据:
 |
① |
② |
③ |
④ |
⑤ |
⑥ |
⑦ |
⑧ |
原子半径(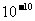 m) m) |
0.74 |
1.60 |
1.52 |
1.10 |
0.99 |
1.86 |
0.75 |
0.82 |
|
|
|
+2 |
+l |
+5 |
+7 |
+1 |
+5 |
+3 |
|
最高或最低化合价 |
-2 |
|
|
-3 |
-l |
|
-3 |
|
试回答下列问题
(1)上述元素中处于同一主族的有___________(填元素编号,有几组填几组)元素②在周期表中的位置为_____________周期___________族;
(2)元素①、⑥能形成两种化合物,写出其中较稳定的化合物与水反应的离子方程式__________________________________________________________。
(3)上述元素中最高价氧化物对应的水化物酸性最强的是______(填元素编号),它与元素④形成的化合物中每个原子都满足最外层为8电子的稳定结构,写出该化合物的电子式_______。
25.(8分)A、B、C、D、E五种元素,其中A、B、C、E为短周期元素,A元素的周期数、主族数、原子序数均相同,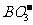 离子中含有32个电子,C元素的原子最外层电子数比次外层电子数少2个,C的阴离子与D的阳离子具有相同的电子层结构,C和D可形成化合物D:C,B、E同主族,且E比B的电子层数多l。
离子中含有32个电子,C元素的原子最外层电子数比次外层电子数少2个,C的阴离子与D的阳离子具有相同的电子层结构,C和D可形成化合物D:C,B、E同主族,且E比B的电子层数多l。
请回答下列问题:
(1)C、D两种元素的元素符号分别是:C__________、D__________。
(2)A、B两元素形成化合物的空间构型为________型,其中B原子取________杂化;
(3)E元素的价电子的电子排布式是__________,A、B两种元素形成化合物的熔点总高于A、E两种元素形成化合物的熔点,其原因是____________;
(4)A、B、C可形成两种既含离子键又含共价键的化合物,它们的化学式分别是和________、__________.
24.(6分)近年来科学家在用微小激光技术研究液氢时,发现分子间作用力也可引起粒子间的反应,美国夏威夷联合天文台的科学家发现了一种新的氢粒子。该粒子是在液氢中由氢分子和质子形成的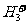 ,其构型为等边三角形,属于二电子三中心离子,同时
,其构型为等边三角形,属于二电子三中心离子,同时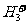 和氢分子可进一步形成
和氢分子可进一步形成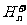 。试回答下列问题:
。试回答下列问题:
(1)一个Ha*中,有_________个质子,___________个中子,_________个电子;
(2)关于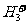 的有关推断,正确的是__________。(填序号)
的有关推断,正确的是__________。(填序号)
A.是氢元素的一种新的同素异形体
B.是氢元素的一种同位素
C.比普通氢分子多一个氢原子核
D.电子式可表示为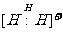
E.可在液氢中形成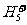 、
、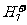 、
、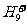
F.可在液氢中形成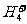 、
、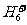 、
、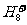
G.可广泛存在于固态、液态和气态氢中
23.(6分)请在下表中分别写出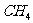 、
、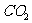 、
、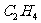 .三种分子的空间构型、键角、碳原子杂化方式以及分子的极性。
.三种分子的空间构型、键角、碳原子杂化方式以及分子的极性。
|
|
分子的空间构型 |
键角 |
碳原子杂化方式 |
分子极性 |
|
CH4 |
|
|
|
|
|
C02 |
|
|
|
|
|
C2H4 |
|
|
|
|
22.(6分)一般认为:如果两个成键元素间的电负性差值大于1.7,它们之间通常形成离子键;如果两个成键元素间的电负性差值小于1.7,它们之间通常形成共价键。请查阅下列化合物中元素的电负性数值,判断它们哪些是共价化合物,哪些是离子化合物。
(1)NaF (2)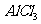 (3)NO (4)MgO (5)
(3)NO (4)MgO (5)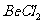 (6)
(6)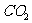
|
元素 |
Al |
B |
Be |
C |
Cl |
F |
K |
Mg |
N |
Na |
O |
P |
S |
Si |
|
电负性 |
1.5 |
2.0 |
1.5 |
2.5 |
2.8 |
4.0 |
1.0 |
1.2 |
3.0 |
0.9 |
3.5 |
2.1 |
2.5 |
1.7 |
共价化合物有(填编号)___________________________________________;
离子化合物有(填编号)___________________________________________。
21.(6分)有下列物质:NaCl、NaOH、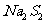 、
、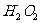 、
、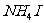 、Ar、
、Ar、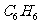 、
、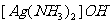
请按要求回答下列问题(用化学式填写):
(1)其中只含有离子键的是_____________________________;
(2)其中既含有离子键又含非极性共价键的是____________________________;
(3)其中含有极性共价键和非极性共价键的非极性分子是___________________;
(4)其中既含有离子键,又含有极性共价键和配位键的是_____________________。
20.X是核外电子数最少的元素,Y是地壳中含量最丰富的元素,Z元素的原子3s、3p能级上电子数相等,W可形成自然界中最硬的物质。下列叙述中错误的是
A.Z和W两元素的原子都可与x的原子构成正四面体结构的分子
B.Y和W的原子可构成非极性分子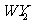 ,也可构成极性分子WY
,也可构成极性分子WY
C.四种元素中x的电负性最大
D.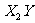 和
和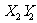 都是只含极性键的极性分子
都是只含极性键的极性分子
第Ⅱ卷(非选择题50分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com