
17.下列指定微粒的个数比为2:1的是
A.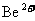 离子中的质子和电子
离子中的质子和电子
B.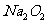 (过氧化钠)固体中的阳离子和阴离子
(过氧化钠)固体中的阳离子和阴离子
C.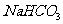 晶体中的阳离子和阴离子
晶体中的阳离子和阴离子
D.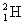 原子中的中子和质子
原子中的中子和质子
16.下列说法不正确的是
A.任何化学反应都伴有能量变化
B.化学反应达到平衡状态时,只要条件不改变,各物质的浓度就不再改变
C.化学反应的速率和限度均可通过改变化学反应条件而改变
D.任何化学反应,只要化学反应的速率很快,理论上都能设计成原电池
15.下列关于化学反应的叙述正确的是
①人们可以认识化学反应,并可创造适宜条件调控化学反应
②化学反应可以制备人们需要的物质或提供人类需要的能源
③化学反应一定有化学键的断裂和形成
④化学反应可分为化合、分解、置换和复分解四种基本反应类型
A.①②③④ B.仅①② C.仅②③ D.仅③④
14.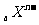 和
和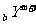 为两主族元素的离子,它们的电子层结构相同。下列判断错误的是
为两主族元素的离子,它们的电子层结构相同。下列判断错误的是
A.原子半径X<Y B.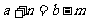
C.Y最高价氧化物的化学式为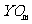 D.X的氢化物的化学式为HnX
D.X的氢化物的化学式为HnX
13.下列反应过程中,同时有离子键和共价键断裂和形成的是
A.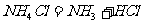
B.
C.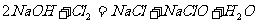
D.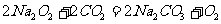
12.下列叙述中,正确的是
A.两种微粒,若核外电子排布完全相同,则其化学性质一定相同
B.凡单原子形成的离子,一定具有稀有气体元素原子的核外电子排布
C.两原子的核外电子排布相同。则两原子一定属于同种元素
D.一种分子与一种离子的电子数与质子数可能同时相等
11.下列说法中错误的是
A.原子及其离子的核外电子层数等于该元素所在的周期数
B.元素周期表中从ⅢB族到ⅡB族10个纵行的元素都是金属元素
C.除氦外的稀有气体原子的最外层电子数都是8
D.同一元素的各种同位素的物理性质、化学性质均相同
10.273K时,反应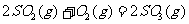 生成2 mol
生成2 mol 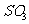 ,放出393.2kJ的热量。在该温度下,向一固定容积的密闭容器内通人2 mol
,放出393.2kJ的热量。在该温度下,向一固定容积的密闭容器内通人2 mol 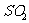 和I mol
和I mol 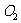 ,达到平衡时,放出热量为
,达到平衡时,放出热量为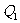 ;向另一容积相同的密闭容器中通人l mol
;向另一容积相同的密闭容器中通人l mol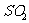 和0.5 mol
和0.5 mol 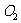 ,达到平衡时放出热量为
,达到平衡时放出热量为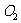 。则下列判断不正确的是
。则下列判断不正确的是
A.情况1的化学反应速率比情况2的大(用同种物质的浓度变化来表示)
B.情况1平衡时, 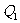 =393.2kJ
=393.2kJ
C.达到平衡时,混合气体的密度,情况1比情况2大
D.情况2平衡时,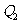 <196.6kJ
<196.6kJ
9.可逆反应: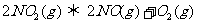 ,在体积不变的密闭容器中反应。达到平衡状态的标志是
,在体积不变的密闭容器中反应。达到平衡状态的标志是
①单位时间内生成n mol 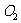 的同时生成2n tool
的同时生成2n tool 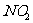
②单位时间内生成n mol 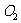 的同时生成2n tool
NO
的同时生成2n tool
NO
③用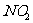 、NO、
、NO、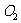 的物质的量浓度变化表示的反应速率的比为2:2:l的状态
的物质的量浓度变化表示的反应速率的比为2:2:l的状态
④混合气体的颜色不再改变的状态
⑤混合气体的密度不再改变的状态
A.仅①④ B.仅②③⑤ C.仅①③④ D.①②③④⑤
8.根据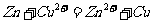 的反应原理设计一个原电池,当Zn为负极时,正极不可以 选用的材料是
的反应原理设计一个原电池,当Zn为负极时,正极不可以 选用的材料是
A.铂 B.石墨 C.铜 D.锌
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com