
27.(4分)在容积为2L的恒容密闭容器中,充人1
mol 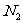 和3 mol
和3 mol  ,在一定条件下反应,2分钟后达到平衡状态,相同温度下,测得平衡时混合气体的压强比反应前混合气体的压强减小了击。请填写下列空白:
,在一定条件下反应,2分钟后达到平衡状态,相同温度下,测得平衡时混合气体的压强比反应前混合气体的压强减小了击。请填写下列空白:
(1)平衡时混合气体中三种气体的物质的量之比为n( ):n(
):n( ):n(
):n( )_____________________
)_____________________
(2)2分钟内,用 的浓度变化表示的平均反应速率为_______________
的浓度变化表示的平均反应速率为_______________
26.(8分)如图是一位同学设计的实验室制取氯气的实验装置图。
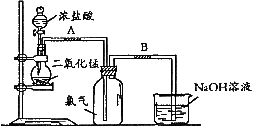
(1)写出该反应的化学方程式________________________________________
(2)上述反应中,还原剂是__________,若有lmol氧化剂参加反应,生成的氯气在标准状况下的体积为__________L;
(3)实验开始前,某学生对装置进行了气密性检查。方法是:连接好装置后,用弹簧夹夹住_______处(填“A”或“B”)橡皮管;打开活塞向分液漏斗中加水,当加到一定量时,停止加水,静置观察,当观察到分液漏斗中_______________________________________时,表明该装置不漏气;
(4)指出这套装置中存在的错误______________________________________________
(5)烧杯里装有氢氧化钠溶液,其作用是_____________________,发生反应的化学方程式是_______________________________________________________________
25.(4分)甲同学取三份完全相同的锌粒,放人三只烧杯中,然后在①、②两只烧杯中分别加入2 mot· 盐酸、稀硫酸各45 mL,在③烧杯中加入刚刚用5
mL l8 mol·
盐酸、稀硫酸各45 mL,在③烧杯中加入刚刚用5
mL l8 mol· 的浓硫酸稀释而配制的45 mL稀硫酸。若反应终止时,生成的气体一样多,且锌粒没有剩余。
的浓硫酸稀释而配制的45 mL稀硫酸。若反应终止时,生成的气体一样多,且锌粒没有剩余。
请回答下列问题:
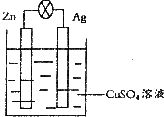
(1)参加反应的锌的质量:①__________②(填“>”、“<”或“=”,下同);
(2)反应速率:① __________②;
(3)反应完毕所需时间:②__________③;
(4)乙同学在烧杯中加入2
mol· 盐酸45 mL,所用锌的质量与甲相同,生成同样多气体耗时间与②号相同,乙同学采取的措施可能是______________________________
盐酸45 mL,所用锌的质量与甲相同,生成同样多气体耗时间与②号相同,乙同学采取的措施可能是______________________________
24.(6分)1932年美国化学家鲍林首先提出了电负性的概念。电负性(用X表示)也是元素的一种重要性质,下表给出的是原子序数小于20的l6种元素的电负性数值1
|
元素 |
H |
U |
Be |
B |
C |
N |
O |
F |
|
电负性 |
2.1 |
1.0 |
1.5 |
2.0 |
2.5 |
3.0 |
3.5 |
4.O |
|
元素 |
Na |
Mg |
AI |
Si |
P |
S |
Cl |
K |
|
电负性 |
0.9 |
1.2 |
1.5 |
1.7 |
2.1 |
2.3 |
3.0 |
0.8 |
分析表中数据,回答下列有关问题:
(1)预测周期表中电负性最大的元素应为_______,钙元素电负性的取值范围为:_______<X<_______;
(2)根据表中数据分析,同主族内不同元素x值的变化规律是_____________________;元素电负性x值的大小与元素金属性、非金属性之间的关系为________________________________________________________
(3)经验规律告诉我们:当形成化学键的两原子相应元素的电负性差值大于1.7时,所形成的一般为离子键;小于1.7时,一般形成共价键。则 中形成的化学键的类型为__________理由为______________________________________________________________________________________________________________________________________________________。
中形成的化学键的类型为__________理由为______________________________________________________________________________________________________________________________________________________。
23.(7分)短周期中的三种元素x、Y、Z,原子序数依次减小,原子核外电子层数之和是5,X元素原子的最外层电子数是Y和z两元素原子的最外层电子数的总和;Y元素原子的最外层电子数是它的电子层数的2倍,且Y元素最高正价与最低负价的绝对值相等,x和z可以形成 的化合物。
的化合物。
请回答:
(1)X、Y、Z三种元素的元素符号分别为.X_______,Y_______,Z_______;
(2)元素x的原子得电子能力_______ (填“强于”或“弱于”)元素Y的原子,可以用比较__________________________________________的方法来判断;
(3)XZ,的电子式是________,所含化学键类型是_______,属于_______化合物;
(4)写出 与Y的最高价氧化物的水化物按l:1反应的化学方程式:________________________________________________________
与Y的最高价氧化物的水化物按l:1反应的化学方程式:________________________________________________________
22.(8分)在银锌原电池中,以硫酸铜为电解质溶液,锌为______极,电极上发生的是______反应(填“氧化”或“还原”),电极反应式为___________银为____________极,电极上发生的是______________反应(填“氧化”或“还原”),电极反应式_________________银片上观察到的现象是___________________________________;当烧杯中溶液质量变化l9时,电路中有_______mol电子通过。
21.(7分)1956年,杨振宁和李政道提出在弱相互作用中宇称不守恒,并由吴健雄用器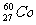 放射源进行了实验验证。次年,杨振宁、李政道两人因此获得诺贝尔物理奖。
放射源进行了实验验证。次年,杨振宁、李政道两人因此获得诺贝尔物理奖。
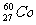 的衰变方程为:
的衰变方程为:

其中,Ve是反中微子,它的电荷为零,静止质量可认为是零。
请回答下列问题(填序号):
(1)下列关于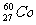 的叙述中,错误的是_______;
的叙述中,错误的是_______;
A.质子数是27 B.电子数是27 C.质量数是27 D.中子数是60
(2)C0与Fe同周期,它位于元素周期表的第_______周期,第________族;
(3)在上述衰变方程中,衰变产物Ni的质量数A为________,核电荷数Z为__________
(4)元素的化学性质主要决定于____________
A.核外电子数 B.核内质子数 C.核内中子数 D.最外层电子数
(5)不同种元素的本质区别是__________。
A.质子数不同 B.中子数不同 C.电子数不同 D.质量数不同
20.用纯净的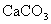 与稀HCl反应制
与稀HCl反应制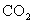 ,实验过程记录如图所示。根据你的分析,判断下列说法中正确是
,实验过程记录如图所示。根据你的分析,判断下列说法中正确是
A.OE段表示反应速率最快
B.EF段表示反应速率最快,收集的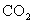 最多
最多
C.FG段表示收集的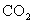 最多
最多
D.FG段表示随着时间的推移,反应速率逐渐变慢

第Ⅱ卷(非选择题共50分)
19.下图为氢氧燃料电池原理示意图,按照此图的提示,下列叙述不正确的是

A.a电极是负极
B.b电极发生氧化反应
C.氢氧燃料电池是一种具有应用前景的绿色电源
D.氢氧燃料电池是一种不需要将还原剂和氧化剂全部储藏在电池内的新型发电装置
18.下列各项中,属于离子化合物所具有的性质的是
A.熔点低 B.导电性差 C.熔融状态下能导电 D.共用电子
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com