
26.(9分)A、B、C、D四种短周期元素的原子序数为A<B<C<D,已知B 原子最外层电子数是次外层电子数的2倍,D原子次外层电子数是最外层电子数的1/3,A 与C能构成一种中性分子M和一种阳离子N,且电子总数均为10个。试回答;
(1)实验室中检验N离子的方法为_________________________________________________。
(2) M的水溶液呈碱性的原因为___________________________________________________。
(3)钠可与D元素形成两种化合物,这两种化合物在固态时属于_________化合物。这两种化合物中有一种能与BD2发生化学反应生成D的单质,其化学方程式为_____________________________________,该化合物中存在的化学键类型为____________。
25.(8分)分别取甲、乙、丙三种烃各1mol,充分燃烧时生成二氧化碳的体积之比为1:3:6,且乙和丙生成相同物质的量的水。甲分子中所有的共价键完全相同,丙的一溴代物只有1种。根据上述性质,回答下列问题:
(1)写出甲与氯气反应生成的有机物为气体的化学方程式___________________________。
(2)乙与HCl加成得到的所有有机物的结构简式为_________________________________。
(3)丙与浓硫酸、浓硝酸混合共热发生取代反应的化学方程式________________________。
24.(9分)利用原电池产生电压的数值可判断形成原电池电极金属性的强弱,现将A、B、C、D四种金属片放置在盐溶液中形成原电池,如图所示,记录电子流动方向和电压表读数如下:(已知:构成两极的金属活动性相差越大,电压表的读数越大。)
|
金属 |
电子流动方向 |
电压(V) |
|
A |
 A Cu A Cu |
0.78 |
|
B |
 Cu B Cu B |
0.15 |
|
C |
 C Cu C Cu |
1.35 |
|
D |
 D Cu D Cu |
0.30 |
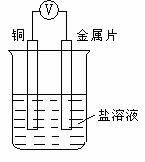
根据表中数据判断:
(1)___________金属是最强的还原剂,_________金属一定不能从硫酸铜溶液中置换出铜。
(2)当D与C组成原电池时,溶液中的阳离子流向_______极,电流流向为______________
(3)已知A、C两种金属为镁和铝,则镁和铝对应的字母分别为____________,为进一步确定结论是否正确,甲同学设计了一个实验,他将两块金属片分别放进氢氧化钠溶液中,现象为_________________________________________有关的化学方程式为__________________________________。另一位同学则在甲实验的基础上,将两金属片用导线连接,则有气泡冒出的金属片为_________(填元素符号)。
23.(12分)某同学探究同周期元素性质递变规律时,设计了如下实验,请根据实验填写下列空白:
|
实验步骤 |
实验现象 |
化学方程式 |
|
①取少量金属钠,放入MgCl2溶液中 |
钠剧烈反应,产生白色沉淀。 |
|
|
② |
|
Mg+2HCl=MgCl2+H2↑ 2Al+6HCl=AlCl3+3H2↑ |
|
③向新制的H2S溶液中滴加新制的氯水 |
|
|
通过以上探究,该同学得到的实验结论是__________________________________。
22.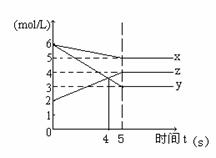 (10分)某温度时,在一个2L的密闭容器中, X、Y、Z三种气体的物质的量浓度随时间的变化曲线如图所示,根据图中数据 填写下列空白:
(10分)某温度时,在一个2L的密闭容器中, X、Y、Z三种气体的物质的量浓度随时间的变化曲线如图所示,根据图中数据 填写下列空白:
(1)反应到5秒时,用X表示的反应速率v (X)=________,反应在4秒时Y和Z的反应速率之比为______。
(2)下列说法能表示该反应达到平衡状态的是( )
A.容器内气体密度不再变化
B.X的消耗速率与Y的消耗速率之比为1:3
C.容器内气体平均相对分子质量不再变化
D.X的消耗速率与Z的消耗速率之比为1:2
(3)若反应正方向为放热反应,平衡后升高温度,v (正)_____ v (逆) (填“>”“<”或“=”),Z的百分含量将_______(填“增大”“减小”或“不变”)
21.(6分)下列所列的是一组你熟悉的物质
①Cl2 ②I2 ③NaOH ④CaO ⑤H2O2 ⑥CH4
(1)上述物质中只含离子键的是__________(填序号,下同),既含共价键又含离子键的是_______________,属于共价化合物的是____________。
(2) CH4在氧气中燃烧是_________能转化为__________能,相同物质的量的①和②与等量的氢气反应,放出热量多的是_________。
20. 一定条件下,反应2SO2+O2 2SO3达到平衡,n(SO2):n(O2):n(SO3)=2:3:4。缩小体积,反应再次达到平衡时,n(O2)=0.8mol,n(SO3)=1.4mol,此时SO2的物质的量应是
一定条件下,反应2SO2+O2 2SO3达到平衡,n(SO2):n(O2):n(SO3)=2:3:4。缩小体积,反应再次达到平衡时,n(O2)=0.8mol,n(SO3)=1.4mol,此时SO2的物质的量应是
A.0.4mol B.0.6mol C.0.8mol D.1.2mol
第Ⅱ卷(非选择题 共60分)
19.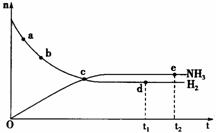 对于密闭容器中的反应:
对于密闭容器中的反应:
 N2(g)+3H2(g) 2NH3(g )(正反应为放热反应),400℃、3.0×106Pa下n(NH3)和n(H2)随时间变化的关系如图所示。下列叙述正确的是
N2(g)+3H2(g) 2NH3(g )(正反应为放热反应),400℃、3.0×106Pa下n(NH3)和n(H2)随时间变化的关系如图所示。下列叙述正确的是
A.点a的正反应速率比点b的小
B.点c处反应达到平衡
C.点d(t1时刻)和点e(t2时刻)处n(N2)不一样
D.其它条件不变,500℃时反应至t1时刻,n(H2)比图中d点的值大
18.A、B、C、D为常见非金属元素,A、B在反应中各结合1个电子形成稳定结构,放出能量B<A;氢化物稳定性HD>HA;原子序数C<B,其稳定结构的核外电子数相等。则四种元素原子得电子能力由强到弱的顺序正确的是
A.A>B>C>D B.B>A>C>D C.D>A>B>C D.B>A>D>C
17.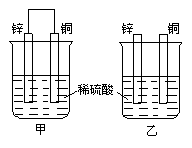 将纯锌片和纯铜片按下图所示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是
将纯锌片和纯铜片按下图所示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是
A.两烧杯中铜片表面均无气泡产生
B.甲中铜片是正极,乙中铜片是负极
C.两烧杯中发生反应的总方程式相同
D.产生气泡的速度甲比乙慢
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com