
6.下列有关化学基本概念的判断依据正确的是
A.氧化还原反应:元素化合价是否变化
B.共价化合物:是否含有共价键
C.强弱电解质:溶液的导电能力大小
D.金属晶体:晶体是否能够导电
5.下列过程或现象,与盐类水解无关的是
A.纯碱溶液去油污 B.铁在潮湿的环境下生锈
C.加热氯化铁溶液颜色变深 D.浓硫化钠溶液有臭鸡蛋气味
4.为了避免青铜器生成铜绿,以下方法最好的是
A.将青铜器放在银质托盘上
B.将青铜器掩埋在含较多Fe3+、Al3+的酸性土壤中
C.将青铜器保存在潮湿的空气中
D.在青铜器的表面覆盖一层防渗的高分子膜
3.向水中加入下列物质,能使水的电离程度增大的是
A.NaCl B.NH4C1 C.HCl D.NaOH
2.下列性质不能用金属键理论解释的是
A.导电性 B.导热性 C.锈蚀性 D.延展性
1.下列化学史实的叙述中不正确的是
A.1803年,英国化学家道尔顿建立了原子学说
B.1903年,汤姆逊提出了原子结构的“葡萄干布丁”模型
C.1911年,卢瑟福提出了原子结构的核式模型
D.1913年,玻尔建立起原子结构的量子力学模型
20.(20分)下图所示为物质制备的部分仪器装置,某校化学兴趣小组欲利用这些装置完成有关实验(仪器装置可任意选用,必要时可重复选择)。
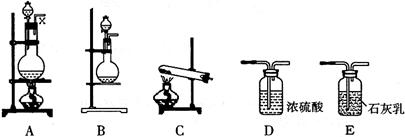
(1)甲小组欲用乙醇、乙酸和浓硫酸制取乙酸乙酯。请回答:
①选用的装置是 (填代号);
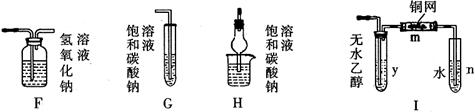
②饱和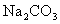 ,溶液的作用是
。
,溶液的作用是
。
③假若某学生选用装置A作为反应发生装置,且加长了竖导管x,导管x的作用是
。(2)乙小组欲用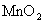 、
、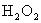 和乙醇为原料,选用装置B和I制取
和乙醇为原料,选用装置B和I制取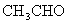 。请回答:
。请回答:
①需要加热的仪器装置有 (填代号);
②写出实验过程中有关反应的化学方程式 。
(3)丙小组欲用浓盐酸、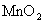 和石灰乳制备漂白粉。请回答:
和石灰乳制备漂白粉。请回答:
①实验中制取氯气的离子方程式是 ;
②如果用足量的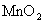 与10mol/L浓盐酸加热反应,得到标准状况下的氯气2.24L,则有 mol电子转移;所用盐酸的体积大于40mL,原因是
。
与10mol/L浓盐酸加热反应,得到标准状况下的氯气2.24L,则有 mol电子转移;所用盐酸的体积大于40mL,原因是
。
19.(11分)已知A、B、C、D、E、F是短周期中的6种非金属元素,它们的原子序数依次增大。B原子的最外层电子数是内层电子数的2倍,A的单质在F的单质中燃烧产生苍白色火焰。E、F在元素周期表中处于相邻的位置,E元素与D元素同主族。M、N是由A、B两种元素形成的化合物,一个M分子中含有4个A原子和2个B原子;N分子为平面六边形结构,且A、B原子个数之比为1:1,在常温下为无色液体,不能使酸性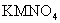 溶液褪色。
溶液褪色。
请回答下列问题:
(1)C元素的名称为 ;F元素阴离子的结构示意图为 。
(2)D、E形成的氢化物的稳定性由强到弱的排列顺序为 (填化学式)。
(3)将M通入溴的四氯化碳溶液中,现象为 ,该反应的化学方程式为 。
(4)N分子的结构特点为 。将N加入溴水中,振荡、静置后的现象为 。
18.(8分)某些有机化合物相互转化的关系如下图(反应需要的其他无机物或生成的无机物已略去)。已知A的产量是衡量一个国家石油化工发展水平的标志,E能使紫色的石蕊试液变红色,其化学式为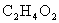 ,F属于酯类化合物,B为高分子化合物。已知:乙醛在催化剂作用下可被氧化为乙酸。
,F属于酯类化合物,B为高分子化合物。已知:乙醛在催化剂作用下可被氧化为乙酸。
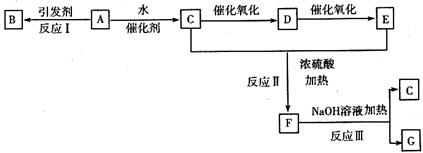
请回答下列问题:
(1)写出C中能决定其主要化学性质的原子团的名称 ,E中决定其使紫色石蕊试液变红色的原子团的结构简式为 。
(2)写出下列有关反应的化学方程式:
反应I ;
反应Ⅱ ;
反应Ⅲ 。
17.(9分)现用纯净的锌片与pH=a的稀硫酸反应制取氢气,请回答下列问题。
(1)写出反应的离子方程式 。
(2)实验过程如下图所示,通过分析比较,发现产生氢气的速率v(OE)<v(EF),试分析原因 。
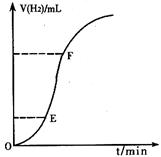
(3)为了加快反应速率,采取了下列措施,你认为可行的是 。
A.加入蒸馏水 B.加入浓盐酸 C.升高温度
(4)某中学为了节约药品,利用铜和浓硫酸反应后的废液经过滤、稀释得到pH= a的稀溶液,做上述实验,发现反应速率明显加快。请你分析原因 。根据上述实验,请你推测在实验室制取氢气时所用的锌片是粗锌好还是纯锌好 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com