
11.用NA代表阿伏加德罗常数值,下列说法正确的是 ( )
A.9g重水所含的电子数为5NA
B.1molMgC12中含有离子数为NA
C.7.1g氯气与足量NaOH溶液反应转移的电子数为0.2NA
D.1molC10H22分子中价键总数为31NA
10.下列离子方程式书写正确的是 ( )
A.碳酸氢钙溶液中加入过量的氢氧化钠溶液:HCO3-+OH-
CO32-+H2O
B.氯化铁溶液中通入硫化氢气体:2Fe3++S2- 2Fe2++S↓
C.次氯酸钙溶液中通入过量的二氧化碳:
Ca2++2C1O-+H2+CO2
CaCO3↓+2HC1O
D.氯化亚铁溶液中加入硝酸:3Fe2++4H++NO3-
3Fe3++2H2O+NO↓
9.根据下列反应判断有关物质还原性由强到弱的顺序是 ( )
H2SO3+I2+H2O 2HI+H2SO4
2FeC13+2HI 2FeC12+2HC+I2
3FeC12+4HNO3
3FeC13+NO↑+2H2O+Fe(NO3)2
A.H2SO3>I->Fe2+>NO B.I->Fe2+>H2SO3>NO
|
25.(12分)有三种不同质量比的氧化铜与炭粉的混合物样品①、②、③。甲、乙、丙三同学各取一种样品,加强热充分反应,测定各样品中氧化铜的量。
(1)甲取样品①强热,若所得固体为金属铜,将其置于足量的稀硝酸中微热,产生1.12L气体(标准状况),则样品①中氧化铜的质量为________g。
(2)乙取样品②ag强热,生成的气体不能使澄清的石灰水变浑浊。再将反应后的固体与足量的稀硝酸微热,充分反应后,有bg固体剩余,该剩余固体的化学式为________。样品②中氧化铜质量为_________g(以含a、b的代数式表示)。
(3)丙称量样品③强热后剩余的固体,质量比原样品减小了cg,若该固体为金属铜,则样品③中氧化铜物质的量(n)的取值范围为_________________________。
21(5分)指出在使用下列仪器(已经洗涤干净)或用品时的第一步操作:
①石蕊试纸(检验气体):___________ ________________________________。
②容量瓶:______________________ __________________________________。
③滴定管:__________________________ ______________________________。
④集气瓶(收集氯化氢):______________ _____________________________。
⑤托盘天平_____________________________ ___________________________。
22(13分)图2是一个制取氯气并以氯气为原料进行特定反应的装置。
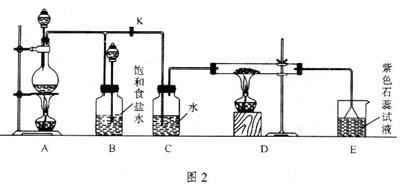
(1)A是氯气发生装置,其中发生反应的化学方程式为__________________________。
(2)实验开始时,先点燃A处的酒精灯,打开旋塞K,让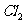 充满整个装置,再点燃D处酒精灯,连接上E装置。
充满整个装置,再点燃D处酒精灯,连接上E装置。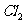 通过C瓶后再进入D。D装置的硬质玻管内盛有炭粉,发生氧化还原反应,其产物为
通过C瓶后再进入D。D装置的硬质玻管内盛有炭粉,发生氧化还原反应,其产物为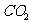 和HCl。试写出D中反应的化学方程式:______________________,装置C 的作用是__________________________。
和HCl。试写出D中反应的化学方程式:______________________,装置C 的作用是__________________________。
(3)在E处,紫色石蕊试液的颜色由紫色变为红色,再变为无色。其原因是
__________________________。
(4)若将E处烧杯中溶液改为澄清石灰水,反应过程中现象为_____________ (选填序号)。
A.有白色沉淀生成
B.无明显的现象
C.先生成白色沉淀,而后白色沉淀消失。
(5)D处反应完毕后,关闭旋塞K,移去酒精灯,但由于余热的作用。A处仍有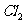 产生,此时B中的现象是_____________,B的作用是_____________。
产生,此时B中的现象是_____________,B的作用是_____________。
(6)若实验中使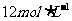 浓盐酸10mL与足量的
浓盐酸10mL与足量的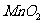 反应。则生成的
反应。则生成的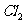 的物质的量总是小于0.03mol,试分析可能存在的原因是①_____________,②_____________。欲使反应生成的
的物质的量总是小于0.03mol,试分析可能存在的原因是①_____________,②_____________。欲使反应生成的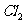 的物质的量最大程度的接近0.03mol。则实验中应采取的措施是_____________。
的物质的量最大程度的接近0.03mol。则实验中应采取的措施是_____________。
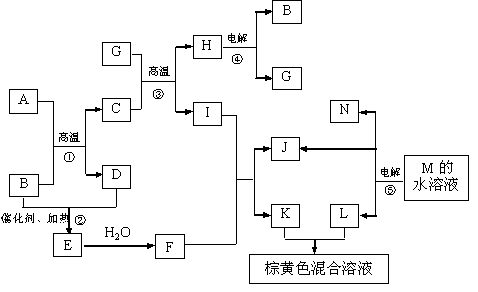
23(12分)根据反应框图填空,已知反应①-⑤均为工业生产及应用中常见反应,其中B、G、I、J、L均为常见单质,B、J、L为气体。A是工业生产中重要的矿石原料的主要成份,其相对分子质量为120。
(1)写出A、B的化学式A__________________ B____________________
(2)写出下列化学反应方程式:
反应②的化学方程式_________________________________________________
反应③的化学方程式_________________________________________________
反应⑤的离子方程式_________________________________________________
(3)写出下列反应在工业生产所使用设备的名称
反应①所使用设备的名称_________________________________
24.(4分)为了测定K2CO3和NaHCO3混合物的组成,某学生每次称取一定质量的混合物溶于水配成溶液,向其中加入相同浓度的Ba(OH)2溶液,每次实验均充分反应,实验结果记录如下表:
|
实验次数 |
混合物的质量/g |
所加Ba(OH)2溶液的体积/L |
测得沉淀的质量/g |
|
1 |
0.858 |
0.5 |
1.379 |
|
2 |
1.716 |
0.5 |
|
|
3 |
2.574 |
0.5 |
4.137 |
|
4 |
3.432 |
0.5 |
5.516 |
|
5 |
4.290 |
0.5 |
5.516 |
|
6 |
5.148 |
0.5 |
5.516 |
请回答下列问题:
(1)第二次实验中产生沉淀的质量是 g。
(2)混合物中K2CO3和NaHCO3的物质的量之比为 。
20.已知反应: AgF+ Cl2+ H2O 9AgCl+ AgClO3+ HF+1O2;下列说法正确的是
( )
A.反应中的还原剂只是H2O
B.每生成9mol的AgCl时,消耗掉10mol的AgF
C.反应中的氧化剂是AgF
D.生成1mol O2时,被还原的Cl2为5mol
|
17. 已知:298K时,2SO2(g)+O2(g) 2SO3(g);△H=-197kJ·mol-1。在相同温度下,向某密闭容器中通入2molSO2和1molO2,达到平衡时放出热量Q1;向另一容积相同的密闭容器中通入1molSO2和0.5molO2,达到平衡时放出热量Q2。下列关系式中正确的是 ( )
已知:298K时,2SO2(g)+O2(g) 2SO3(g);△H=-197kJ·mol-1。在相同温度下,向某密闭容器中通入2molSO2和1molO2,达到平衡时放出热量Q1;向另一容积相同的密闭容器中通入1molSO2和0.5molO2,达到平衡时放出热量Q2。下列关系式中正确的是 ( )
A.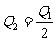 B.
B.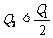 C.
C.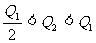 D.
D.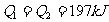
18如图所示,集气瓶内充满某混合气体,置于光亮处,将滴管内的水挤入集气瓶后,烧杯中的水会进入集气瓶,集气瓶气体是
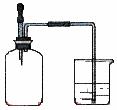
① CO、O2 ② Cl2、CH4 ③ NO2、O2 ④ N2、H2
A.①② B.②④ C.③④ D.②③
19用4种溶液进行实验,下表中“操作及现象”与“溶液”对应关系错误的是( )
|
选项 |
操作及现象 |
溶液 |
|
A |
通入CO2,溶液变浑浊。再升高至65℃以上,溶液变澄清。 |
C6H5ONa溶液 |
|
B |
通入CO2,溶液变浑浊。继续通CO2至过量,浑浊消失。 |
Na2SiO3溶液 |
|
C |
通入CO2,溶液变浑浊。再加入品红溶液,红色褪去。 |
Ca(ClO)2溶液 |
|
D |
通入CO2,溶液变浑浊。继续通CO2至过量,浑浊消失。再加入足量NaOH溶液,又变浑浊。 |
Ca(OH)2溶液 |
16.下列不能说明锌比铜活泼的装置是 ( )
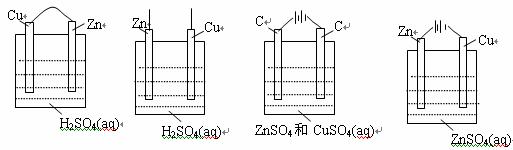
A B C D
15.X、Y、Z均为短周期元素。已知X元素的某种原子核内无中子,Y元素的原子核外最外层电子数是其次外层电子数的2倍,Z元素是地壳中含量最丰富的元素。有下列含该三种元素的化学式:①X2Y2Z2 ②X2YZ3 ③X2YZ2 ④X2Y2Z4 ⑤X3YZ4 ⑥XYZ3,其中可能存在对应分子的是 ( )
A.② B.②④ C.②⑤⑥ D.①②③④
14.下列各组溶液,不用其他试剂就不能鉴别的是 ( )
A.FeCl3、NaNO3、Na2CO3、NaCl B.NaOH、MgSO4、Na2CO3、NaHSO4
C.AgNO3、KNO3、KCl、NaBr D.HCl、BaCl2、NaOH、CuSO4
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com