
4.下列常用的干燥剂中,不能用来干燥氯气的是 ( )
A.浓硫酸 B.无水氯化钙 C.碱石灰 D.磷酸酐(P2O5)
2.下列各物质中,属于非电解质的是 ( )
A.BaSO4 B.Cl2 C.HCl D.SO3
|
A.2H2+O2 2H2O B.H2→2H
C.CaO+H2O=Ca(OH)2 D.2Cl→Cl2
1.下列各元素中,得电子能力最强的是 ( )
A.N B.S C.O D.Si
20.(16分)请分析回答某同学在探究有关浓硫酸、稀硫酸、浓硝酸、稀硝酸分别与铜反应的实验中发生的有关问题。
I.探究上述四种酸氧化性相对强弱及其与铜反应的还原产物的性质
(1)分别向盛有等量铜片的四支试管中加入等体积的①浓硫酸、②稀硫酸、③浓硝酸、④稀硝酸,能随即发生反应的是(填序号,下同) ,微热则发生反应的是 ,加热后发生反应的是 ,加热也不发生反应的是 。由此可以得到上述四种酸氧化性由强到弱的顺序是:
 (2)先将铜与浓硫酸反应产生的气体X持续通入右下图装置中,一段时间后再将铜与浓硝酸反应产生的大量气体Y也持续通入该装置中,可观察到的现象包括(可选多项,但多选倒扣分,下同)
(2)先将铜与浓硫酸反应产生的气体X持续通入右下图装置中,一段时间后再将铜与浓硝酸反应产生的大量气体Y也持续通入该装置中,可观察到的现象包括(可选多项,但多选倒扣分,下同)
A.通入X气体后产生白色沉淀
B.通入X气体后溶液中无明显现象
C.通入Y气体后产生开始沉淀
D.通入Y气体后沉淀溶解
E.通入Y气体后溶液中无明显现象
由此可得到的结论是
A.HNO3 的酸性比H2SO4强 B.盐酸的酸性比H2SO3强
C.BaSO3能溶于盐酸 D.HNO3 能氧化H2SO3(或SO2)
E.BaSO4 不溶于水也不溶于HNO3溶液
II.下图是甲、乙两位同学探究铜与稀硝酸反应还原产物的实验装置图,请回答下列问题:
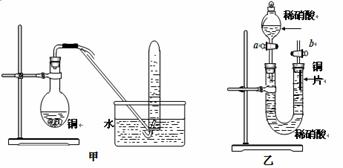
(1)写出铜和稀硝酸反应的离子方程式 。
(2)实验装置甲能否证明铜和稀硝酸反应的产物是NO气体 (填:“能”或“不能”),请阐述理由(包括化学方程式)是
(3)若用实验装置乙进行实验,检查装置气密性的操作是
19.(17分)某同学欲利用教材中的实验装置探究“铝热反应”中熔融物的成份。
请写出“铝热反应”的化学方程式: ,
该同学经查阅《化学手册》知Al、Al2O3、Fe、Fe2O3熔点、沸点数据如下:
|
物质 |
Al |
Al2O3 |
Fe |
Fe2O3 |
|
熔点/℃ |
660 |
2054 |
1535 |
1462 |
|
沸点/℃ |
2467 |
2980 |
2750 |
----- |
(1)该同学推测,铝热反应所得到的熔融物应是铁铝合金。其理由是:
(2)设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝,该实验所用试剂是 ,反应的离子方程式为 。
(3)该同学为确定熔融物中是否还会有残留的Fe2O3 ,将熔融物用酸完全溶解后加入KSCN试剂。请你分析该设计是否正确(填“正确”或“不正确”) ,理由是(用离子方程式表示)
(4)若要测定该熔融物中铝元素的含量,请设计实验,写出所用试剂的名称和实验步骤(不用写化学方程式),列出铝元素含量的计算式。
18.(12分)已知化合物A、B、C、D、E、F、G和单质甲、乙所含元素均为短周期元素,A的浓溶液与甲能发生如图所示的反应。甲在常温下为固体单质,乙是常见的气体单质,B是无色气体,是主要的大气污染物之一,请根据下图所示填空:
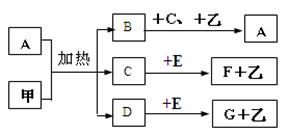
(1)写出下列物质的化学式:A ,G ,
写出反应C+EF+乙的化学方程式: 。
每生成1mol乙气体,需要转移 mol电子。
(2)气体B可用与B含有同一种元素的气体化合物M与其发生氧化还原反应而转化,M的化学式是 __ ,M与B反应的化学方程式为 。
17.(12分)I.下面的虚线框中每一列、每一行相当于周期表的每一族和每一周期,但它的列数和行数都多于元素周期表。请在下面的虚线框中用实线画出周期表第一至第六周期的轮廓,并画出金属与非金属的分界线。
II.X、Y、Z、M、N为短周期的五种主族元素,其中X、Z同主族,Y、Z同周期,M与X、Y既不同主族,也不同周期。X原子最外层电子数是核外电子层数的三倍,Y的最高化合价与其最低化合价的代数和等于6。N是短周期主族元素中原子半径最大的非金属元素。
(1)请写出下列元素的元素符号:X ,Y ,M 。
(2)请写出下列反应的离子方程式:
N单质与NaOH溶液反应:
(3)Y与Z相比,非金属性较强的元素是 ,可以证明该结论的实验是(用离子方程式表示) 。
16.(8分)实验室为监测空气中汞蒸气的含量,往往悬挂涂有CuI的滤纸,根据滤纸是否变色或颜色发生变化所用去的时间来判断空气中的含汞量,其反应为:
4CuI+Hg Cu2HgI4+2Cu
(1)上述反应产物Cu2HgI4中,Hg元素显 价。
(2)以上反应中的氧化剂为 _ ,当有1molCu2HgI4生成时,转移电子数 个。
(3)CuI可由Cu2+与I-直接反应制得,请配平下列反应的离子方程式(化学计量数必须全部填写)。 Cu2++ I- CuI + I3-
15.将标准状况下的a L氯化氢气体溶于100g水中,得到的盐酸的密度为b g/mL,则该盐酸的物质的量浓度(mol/L)是
A.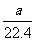 B.
B.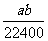
C.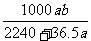 D.
D.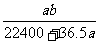
第II卷(非选择题 共65分)
14.用0.1mol/L的Na2SO3溶液30mL,恰好将2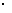 10-3mol的XO4-离子还原,则元素X在还原产物中的化合价是
10-3mol的XO4-离子还原,则元素X在还原产物中的化合价是
A.+1 B.+2 C.+3 D.+4
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com