
25.(8分)0.15mol某金属单质与足量的稀硫酸充分反应后,在标准状况下生成5.04L H2和25.65g该金属的硫酸盐。若该金属元素原子核内的质子数比中子数少一个,试通过计算确定该金属元素在周期表中的位置。
24.(8分)往100mL的NaOH溶液中通入CO2充分反应后,在减压和较低温度下,小心地将溶液蒸干,得到白色固体M。通入的CO2的体积V(标准状况)与M的质量(W)的关系如图所示。试解答下列问题:
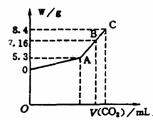
(1)A点时,白色固体M的化学式为 ,通入的CO2的体积为 mL(标准状况下,下同。)
(2)C点时,白色固体M的化学式为 ,通入的CO2的体积为 mL
(3)B点时M的组成成分为 (用学式表示),通入的CO2的体积为 mL
(4)该NaOH溶液的物质的量浓度为 。
23.(8分)下图中的每一个方格表示有关的一种反应物或生成物。已知X为一种盐,其分
解产物中A、B、C的物质的量之比为1:1:1,A为无色无味气体。试完成下列问题:
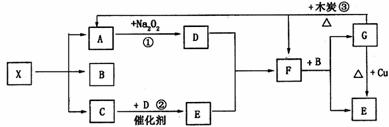
(1)写出下列物质的化学式
X ,F
(2)写出下列反应的化学方程式
反应① ,
反应② ,
反应③ 。
22.(6分)如下图所示,已知A是常见的纯净气体,甲中黑色粉末为氧化铜或炭粉或两者的混合物。
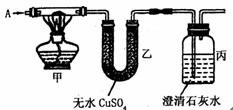
试回答下列问题:
(1)若A为CO2,在丙中导出可燃性气体,则甲中发生反应的反应方程式
(2)若甲中黑色粉末为氧化铜,实验过程中甲处黑色粉末变成红色,乙处无水CuSO4无变化,则通入的A为 ,丙中出现的现象为 ,丙中发生反应的离子方程式为
(3)若乙中无水CuSO4变成蓝色,丙中出现白色浑浊,则通入的A为 ,黑色粉末的成分是
21.(10分)四种短周期的主族元素A、B、C、D在周期表中的位置如图所示。已知它们的原子序数之和为46,最外层电子数之和为22。试完成下列问题:

(1)D元素的阴离子的离子结构示意图为
(2)A、C、D的最高价氧化物所对应的水化物 酸性由强到弱的顺序是:
(3)用有关的方程式解释B元素的氢化物的水溶液的酸碱性:
(4)写出A单质与C的最高价氧化物对应水化物反应的化学方程式:
(5)请根据下面所给的5个热化学方程式,计算出反应④的反应热△H4= .
①NH3(g)+HCl(g)=NH4Cl(s);△H1=-176kJ·mol-1
②NH3(g)+H2O(l)=NH3·H2O(aq);△H2=-35.1kJ·mol-1
③HCl(g)+H2O(l)=HCl(aq);△H3=-72.3kJ·mol-1
④NH4Cl(s)+H2O(g)=NH4Cl(s);△H4=?kJ·mol-1
⑤NH3·H2O(g)+HCl(aq)=NH4Cl(aq)+H2O(l);△H5=-52.3kJ·mol-1
20.(10分)某铝合金(硬铝)中含有镁、铜、硅,为了测定该合金中铝的含量,有人设计如下实验过程(实验前已经将合金样品磨成粉末状)
(1)称取样品a g,称取时使用的仪器名称为 。
(2)将上述样品溶解于足量稀盐酸中,过滤,滤渣中含有
(3)在滤液中加过量NaOH溶液,过滤。
(4)在第(3)步的滤液中通入足量的CO2,充分反应后过滤,将沉淀用蒸馏水洗涤数次后,烘干灼烧至质量不再减少为止。冷却后称量,质量为b g。有关反应的离子方程式为 ,该样品中铝的质量分数为
(5)①若步骤(3)中NaOH溶液的量加入不足,则能使测定结果 (填“偏高”、“偏低”或“不影响”)。
②若步骤(4)中沉淀没有洗涤,则能使测定结果 (填“偏高”、“偏低”或“不影响”)。
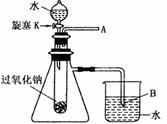
19.(6分)用脱脂棉包住约0.2g过氧化钠固体粉末,置于石棉网上,然后向包有过氧化钠的位置滴加几滴水,结果脱脂棉剧烈燃烧起来。
试完成下列问题:
(1)写出过氧化钠与水反应的化学方程式
(2)由脱脂棉剧烈燃烧可以得出的结论是
(3)某研究性学习小组,为进一步证明上述结论,拟用如图所示的装置进行有关实验。请写出有关的实验操作方法和现象
18.向100mL 0.1mol·L-1的AlCl3溶液中,加入1mol·L-1的NaOH溶液VmL后,再滴加1mol·L-1盐酸。滴加盐酸的体积(横坐标)与生成沉淀的质量(纵坐标)如图示的关系,则加入的NaOH溶液的体积为 ( )
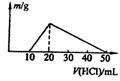
A.10mL B.30ml C.40mL D.50mL
|
17.根据离子方程式:①2Fe3++2I-=2Fe2++I2;②2Fe2++Br2=2Fe3++2Br-,判断有关离子的还原性由弱到强的顺序是 ( )
A.Br-<Fe2+<I- B.I-<Fe2+<Br- C.Br-<I-<Fe2+ D.Fe2+<Br-<I-
16.下列各组物质,不能由单质直接化合而得到的是 ( )
A.FeCl3 B.CuS C.Fe3O4 D.NO
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com