
27.(5分)为确认HCl、H2CO3、H2SiO3的酸性强弱,有人设计用如下图装置,一次实验即可达到目的(不必再选用其它酸性溶液)。请依据此实验填空:
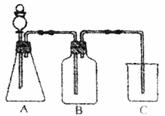
(1)锥形瓶内装某可溶性正盐固体,分液漏斗中所盛试剂是______。
(2)装置B所盛试剂是____________,装置B所盛试剂的作用是__________________。
(3)装置C所盛试剂是____________,出现的现象是____________________________。
26.(6分)有A、B、C、D四种原子序数依次增大的短周期非金属元素(其单质也可分别用A、B、C、D表示)。在一定条件下,A可以分别和B、C、D化合生成甲、乙、丙化合物,且甲、乙两分子中各含有10个电子。B、C元素在周期表中位置相邻,B、C化和可得丁。已知一定条件下有如下变化关系:
①D+乙→丙+戊 ②戊→丙+C ③C+甲→丁+乙
请填空:(1)丙的浓溶液与一种黑色粉末共热可得D,则丙为______,乙为______。
(2)戊的结构式是______,DB4+的电子式是______。(3)写出反应③化学方程式。
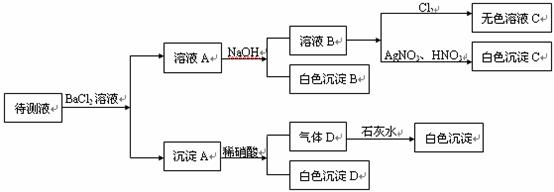
25.(8分)某待测溶液(阳离子为Na+)中可能会有SO42-、SO32-、NO3-、Cl-、Br-、CO32-、 HCO3-中的一种或多种,进行如图所示实验,每次实验所加试剂均过量,回答以下问题:
(1)沉淀B的化学式为____________。
(2)根据以上实验,待测液中肯定没有的离子是______,肯定存在的离子是___________。
24.(8分)物质间的转化关系如下图所示:
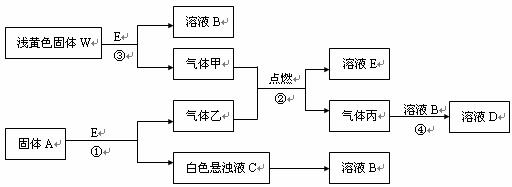
(1)固体A是一种重要的工业原料。1mol气体乙完全燃烧时生成1molE和2mol丙。则丙的电子式为:_____,写出反应①化学方程式:
(2)C溶液中的溶质和丙以物质的量之比1∶2反应时,该反应的离子方程式为:_____________________。实验C→B的转变,加入的物质为______(填写化学式)。
23.(6分)配平化学方程式:
___HNO3+___FeSO4====___Fe(NO3)3+___Fe(SO4)3+ N2O↑+___H2O反应物中发生氧化反应的物质是______,被还原的元素是______,反应中1mol氧化剂______(填“得到”或“失去”)______mol电子。
22.将一定量的Cu和Fe2O3的混合物放入25mL2mol/LHNO3中,反应完成后,无固体剩余,生成224mLNO气体(标准状况),再向反应后的溶液中加入1mol/L NaOH溶液,要使金属元素全部沉淀下来,所加NaOH溶液体积最少是 ( )
A.40mL B.45mL C.50mL D.无法判断
21.过氧化氢(H2O2)是一种黏稠液体,易分解为水和氧气,常用作氧化剂、漂白剂和消毒剂。为了储存、运输使用方便,工业上采用“醇析法”将H2O2转化为固体的过碳酸钠晶体(其化学式为2Na2CO3·3H2O2),该晶体具有Na2CO3和H2O的双重性质。接触下列物质不会使过碳酸钠失效的是 ( )
A.MnO2 B.FeCl2 C.CH3COOH D.NaHCO3
20.要求设计实验,证明某种盐的水解是吸热的,有四位学生分别作出如下回答,其中正确的是 ( )
A.甲学生:将硝酸铵晶体溶于水,若水温下降,说明硝酸铵水解是吸热的
B.乙学生:在盐酸中加入相同温度的氨水,若实验过程中混合液温度下降,说明盐类水解是吸热的
C.丙学生:在醋酸钠溶液中加入醋酸钠晶体,若溶液温度下降,说明盐水类水解是吸热的
D.丁学生:在醋酸钠溶液中滴入酚酞试液,加热后若红色加深,说明盐类水解是吸热的
19.已知某溶液中存在较多的H+、SO42-、NO3-,则溶液中还可能大量存在的离子组是( )
A.Al3+、CH3COO-、Cl- B.Na+、NH4+、Cl-
C.Mg2+、Cl-、Fe2+ D.Mg2+、Ba2+、Br-
18.向50mL18mol/LH2SO4中加入足量的Cu并加热,将加热后所得的混合物溶于水,过滤,
|
A.0.9mol B.0.45mol
C.0.45mol<n<0.9mol D.<0.45mol
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com