
1.考试时间:90分钟; 本卷满分:100分
31.为测定某Fe2O3和FeO混合物中Fe2O3的含量,往一定量样品中加入200 mL 5.0 mol·L─1硫酸,充分反应后,测得溶液体积仍为200 mL,溶液中c(H+)= 1.0 mol·L─1,再加入适量2.0 mol·L─1NaOH溶液,使Fe2+、Fe3+恰好完全沉淀,充分搅拌并微热,待沉淀全部变为红褐色后,过滤、洗涤、灼烧沉淀物,称得固体质量比原样品增加2.4 g。
(1)与样品发生反应的硫酸的物质的量为多少?
(2)需加入多少毫升NaOH溶液,才能使Fe2+、Fe3+恰好沉淀完全?
(3)该混合物中Fe2O3的质量分数是多少?
30.(12分)某化学研究性学习小组讨论Fe3+和SO32─之间发生怎样的反应,提出了两种可能:一是发生氧化还原反应:2Fe3++SO32─+H2O=2Fe2++SO42─+2H+;二是发生双水解反应:2Fe3++3SO32─+6H2O=2Fe(OH)3(胶体)+3H2SO3。为了证明是哪一种反应发生,同学们设计并实施了下列实验,请填写下列空白:
实验Ⅰ:学生选择的实验用品:Na2SO3浓溶液、BaCl2稀溶液、稀盐酸;试管若干、胶头滴管若干。从选择的药品分析,实验作者设计这个实验的目的是 。
实验Ⅱ:取5 mL FeCl3浓溶液于试管中,逐滴加入上述Na2SO3浓溶液,观察到溶液颜色由黄色变为红棕色,无气泡产生,无沉淀生成,继续加入Na2SO3浓溶液至过量,溶液颜色加深,最终变为红褐色。这种红褐色液体是 ;向红褐色液体中逐滴加入稀盐酸至过量,可以观察到的现象是 。
将溶液分成两等份,其中一份加入KSCN溶液,溶液变成血红色,反应的离子方程式为 ;另一份加入BaCl2稀溶液,有少量白色沉淀生成,产生该白色沉淀的离子方程式是 。
实验Ⅲ:换用稀释的FeCl3和Na2SO3溶液重复实验Ⅱ。实验Ⅱ、Ⅲ产生的现象完全相同。由上述实验得出的结论是 。
若在FeCl3浓溶液中加入Na2CO3浓溶液,观察到红褐色沉淀并且产生无色气体,该反应的化学方程式是 。从形式上看,Na2CO3和Na2SO3相似,但是从上述实验中可以看到,二者的水溶液与氯化铁溶液反应的现象差别很大,分析其原因可能是:
① ② 。
29.(14分)某学生利用以下装置探究氯气与氨气之间的反应。其中A,F分别为氨气和氯气的发生装置,C为纯净干燥的氯气与氨气反应的装置。
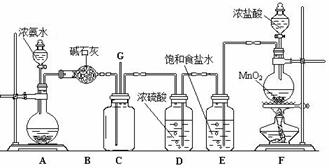
请回答下列问题:
(1)装置A中的烧瓶内固体不可以选用 (选填序号号)。
A.生石灰B.碱石灰C.五氧化二磷D.烧碱
(2)装置F中发生反应的离子方程式为 ;
(3)B装置的作用 ;E装置的作用 ;
(4)通入C装置的两根导管左边较长、右边较短,目的是 ;
(5)装置C内出现浓厚的白烟并在容器内壁凝结,另一生成物是空气的主要成分之一。请写出反应的化学方程式: ;
(6)从装置C的G处逸出的尾气中可能含有黄绿色的有毒气体,如何处理?
。
28. (10分)一种白色晶体A极易溶于水,将A配成溶液进行如下框图所示的实验,实验现象及转化关系如下列框图所示。
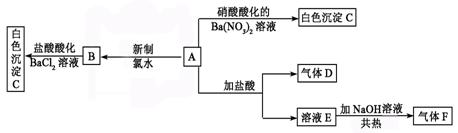
A为正盐,气体D能使品红溶液褪色,气体F能使湿润的红色石蕊试纸变蓝。试回答下列问题:
(1)写出下列物质化学式:A:________________ C:________________
(2)写出气体F的电子式 ,其分子空间构型为
(3)写出下列反应的离子方程式:
①E→F: 。
②A→B: 。
(4)在检验SO42─时,当确定溶液中不含 等干扰离子存在时可选用盐酸酸化的BaCl2溶液;在确定溶液中不含 等干扰离子存在时可选用HNO3酸化的Ba(NO3)2溶液作试剂。
27.(8分)某研究性学习小组在做氯气的喷泉实验时(装置如图),
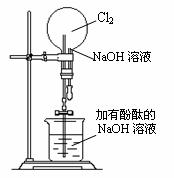 发现含有酚酞的NaOH溶液喷入烧瓶后,溶液的红色褪去。
发现含有酚酞的NaOH溶液喷入烧瓶后,溶液的红色褪去。
甲、乙两位同学对此现象分别做了如下推测:
甲:因为氯气与NaOH溶液反应,使溶液碱性减弱甚至呈酸性,
所以溶液红色褪去。
乙:因为氯气溶于水并与水反应生成HClO,由于HClO的氧化
漂白作用而使溶液褪色。
(1)验证甲同学的推测是否正确的方法是:______________;
验证乙同学的推测是否正确的方法是:_______________。
(2)如果将NaOH溶液改成酸性KMnO4溶液,把Cl2换成SO2气体,试问用图示所给的装置完成喷泉实验是否合理?_______(填“合理”或“不合理”)。如果认为不合理,请说明你的理由_____________________________________________________。
(3)类似“褪色喷泉实验”的还有多种“变色喷泉实验”,请你按实验要求分别设计2个“变色喷泉实验”并填写下列表格:
26.(8分)将一定量的晶体A,隔绝空气加热到200℃时,A全部分解为等物质的量的四种气体。这四种物质与其他的相互转化关系如下图所示,J是一种在生活、生产中使用最广泛的金属单质,C是一种非极性分子。图中部分反应条件及生成物没有列出。
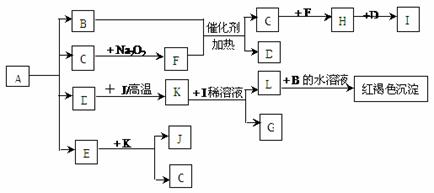
请按要求填空:
(1)单质J的化学式_____________,E的分子式是______________;
(2)写出B和F反应的化学方程式__________________________________________;
(3)写出K和I的稀溶液反应的离子方程式______________________________________;
(4)A的化学式为______________________________。
25.(9分)A、B、C、D、E、F六种元素分布在三个不同的短周期,它们的原子序数依次增大,其中B与C同周期,A与D、C与F分别在同一主族,A、D两元素的原子核内的质子数之和是C、F两元素原子核内质子数之和的一半。又知六种元素所形成的常见单质在常温常压下有三种是气体,三种是固体。请回答下列问题:
(1)由A、C两元素可以组成X、Y两种化合物,X在一定条件下可以分解成Y,X的电子式为______________,其分子属于___________(填“极性”、“非极性”)分子。
(2)E是非金属元素,但能表现出一些金属元素的性质,请写出单质E与氧氧化钠溶液反应的离子方程式______________________________________。
(3)一定条件下,A的气体单质与B的气体单质按n(A) : n(B)=3:1充分反应生成6.8 g气态W时放出18.44 kJ热量,则该反应的热化学方程式
_______________________________。
(4)在10 L的密闭容器中,通入2 mol的FC2气体和3 mol C的气体单质在一定条件下反应生成FC3气体,当反应达到平衡时,单质C的浓度为0.21 mol·L-1,则平衡时FC2的转化率为__________ __。
24.(8分)某强碱性溶液溶质为K+、NH4+、AlO2-、SO42-、CO32-、Al3+、SiO32-、Cl-、OH-中的某几种,现进行如下实验:①取少量溶液用硝酸酸化后,加Ba(NO3)2溶液,无沉淀生成;②另取少量溶液加入盐酸的现象是:开始无明显现象,后来沉淀逐渐增多,沉淀量不增加后产生一种气体,最后沉淀逐渐溶解直至消失。
(1)原溶液中肯定存在的离子有 ,肯定不能大量存在的离子有 。
(2)②中产生沉淀的离子方程式 ,沉淀溶解的离子方程式为 。
23.(7分)常温下某种淡黄色固体甲,与气态氢化物乙和氧化物丙之间有如图所示的转化关系。试回答下列问题:
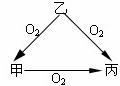
(1)甲是(填化学式,下同)_____ ___,
乙是______ ___,丙是____ ____。
(2)乙和丙发生反应时,无论乙和丙的物质的量之比如何,反应得到的氧化产物与还原产物的质量比总是 : 。
(3)若甲在常温下是气体,它与气态氢化物乙和氧化物丙之间的转化关系仍然如此图所示,则甲是_______,乙是________,丙是_______。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com