
23.试分析下图中各物质间的反应关系。
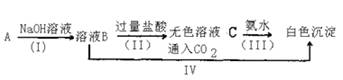
已知A是地壳中含量最高的金属元素的单质,写出上列各步反应的离子方程式。
(Ⅰ) 。
(Ⅱ) 。
(Ⅲ) 。
(IV) 。
22.现有含FeC12杂质的氯化铜晶体(CuC12·2H2O),为制取纯净的CuC12·2H2O,首先将其制成水溶液,然后按下图所示步骤进行提纯:
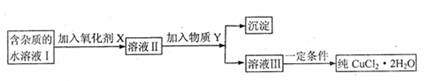
已知H2O2、KMnO2、NaC1O、K2Cr2O7均具有强氧化性,要将溶液中的Cu2+、Fe2+、Fe3+沉淀为氢氧化物,需溶液的pH分别为6.4、6.4、3.7,
请回答下列问题
(1)本实验最适合的氧化剂X是 。
A.K2Cr2O7 B.NaC1O C.H2O2 D.KMnO4
(2)物质Y不可能是 。
A.CuO B.CuC12 C.Cu(OH)2 D.CuCO3
(3)除去Fe3+的有关离子方程式是(物质Y在(2)中选择合适的选项): 。
(4)加入氧化剂的目的是 。
(5)最后能不能直接蒸发结晶得到CuC12·2H2O? 。(填“能”或“不能”)。如不能,应如何操作?(如能,此空不填) 。
21.有下面两种方未能可制得白色Fe(OH)2沉淀。
方法一:用不含Fe3+的FeSO4溶液与不含O2的蒸馏水配制的NaOH溶液反应制备。
(1)用硫酸亚铁晶体配制上述FeSO4溶液还需加入 。
 (2)除去蒸馏水中溶液的O2常采用
的方法。
(2)除去蒸馏水中溶液的O2常采用
的方法。
(3)生成白色Fe(OH)2沉淀的操作是用长滴管吸取不
含O2的NaOH溶液,插入FeSO4液面下,再挤出
NaOH溶液,这样操作的理由是
。
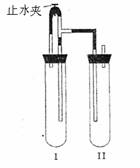
方法二:在如图所示的装置中,用NaOH溶液、铁屑、稀H2SO4试剂制备。
(1)在试管Ⅰ里加入的试剂是
。
(2)在试管Ⅱ里加入的试剂是
。
20.用标准的相加酸滴定未知氢氧化钠溶液,下列操作将对c(NaOH)有何影响?(填偏高、偏低或无影响)
(1)滴定前对酸式滴定管读数时,视线低于水平线,滴定结束时读数正确 。
(2)预先未用标准盐酸溶液润洗酸式滴定管 。
(3)滴定前锥形瓶中残留少量蒸馏水,就向锥形瓶中加待测液 。
(4)酸式滴定管未赶气泡就开始滴定,滴定结束后气泡消失 。
19.取体积相同(0.025L)的两份0.10mol/L NaOH溶液,把其中一份放在空气中一段时间后,溶液的pH (填“增大、减小或不变”),其原因是 。(用离子方程式表示)
已知浓度的硫酸溶液中和上述两份溶液,若中和第一份(在空气中放置一段时间)所消耗硫酸的体积为VA,中和另一份消耗硫酸溶液的体积为VB,则:
(1)以甲基登为指示剂时,VA与VB的关系是 。
(2)以酚酞为指示剂时,VA与VB的关系是 。
18.现有S2-、SO32-、NH+4、A13+、HPO42-、Na+、SO42-、A1O2-、Fe3+、HCO3-、C1-等离子,请按要求填空:
(1)在水溶液中,该离子水解呈碱性的是 。
(2)在水溶液中,该离子水解呈酸性的是 。
(3)既能在酸性较强的溶液里大量存在,又能在碱性较强的溶液里大量存在的离子有 。
(4)既不能在酸性较强的溶液里大量存在,又不能在碱性较强的溶液里大量存在的离子有 。
|
17.某盐的化学式XmYn为最简结构(m≠n),将一定量的该盐溶于足量水时:
(1)若测得溶液的PH为5,则该盐与水反应的离子方程式可能为 。
(2)若测得该溶液的PH为9,则该盐水反应的离子方程式可能为 ,
(3)若x、y为同周期的短周期元素,XmYn溶于水时,既有白色沉淀产生,又有无色气体放出,则XmYn溶于水的化学方程式为 。
16.(1)将下列物质的水溶液蒸干所得固体物质的化学式填写在相应的位置
K2CO3 Na2SO3 FeC13
(2)将等物质的量浓度等体积的硫酸溶液和偏铝酸钾溶液混合,反应后仍留在溶液中的铝元素占原偏铝酸溶液中铝元素的质量分数约为 ,反应后溶液里各离子浓度从大到小的顺序为 。
15.在相同条件下,测得①NaHCO3②CH3COONa③NaC1O三种溶液pH值相同,则它们的物质的量浓度由大到小顺序可能是 ( )
A.①②③ B.③②① C.②①③ D.③①②
14.0.2mol/L的CH3COOK与0.1mol/L的盐酸等体积混合,溶液中下列粒子的物质的量浓度关系正确的是 ( )
A.c(CH3COO-)=c(C1-)>c(H+)>c(CH3COOH)
B.c(CH3COO-)=c(C1-)>c(CH3COOH)>c(H+)
C.c(CH3COO-)>c(C1-)>c(H+)>c(CH3COOH)
D.c(CH3COO-)>c(C1-)>c(CH3COOH)>c(H+)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com