
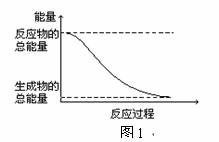
1、下列变化为放热反应的是( )
A.能量变化如图1所示的化学反应
B.H2O(g)=H2O(l);△H=-44.0 kJ/mol
C.形成化学键时共放出能量862 kJ的化学反应
D.2HI(g)=H2(g)+I2(g);△H=+14.9 kJ/mol
29.(15分)下图中A、B、C、D、E、F、G均为有机化合物。
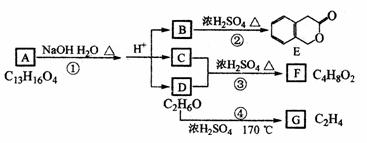
根据上图回答问题:
(1)D的化学名称是 。
(2)反应③的化学方程式是 (有机物须用结构简式表示)
(3)B的分子式是 。A的结构简式是 。反应①的反应类型是 。
(4)符合下列3个条件的B的同分异构体的数目有 个。
①含有邻二取代苯环结构;②与B有相同官能团;③不与FeCl3溶液发生显色反应。写出其中任意一个同分异构体的结构简式 。
(5)G是重要的工业原料,用化学方程式表示G的一种重要的工业用途。
28.(12分)已知A、B、C、D四种短周期元素的原子半径依次减小。在周期表中A与C
位于同一主族,B的最外层电子数为次外层电子数的2倍。C的最外层电子数是其电子总数的3/4,D分别是B、C形成电子总数为10的化合物X、Y。D可与A形成化合物Z。试回答:
(1)A为 ;B为 ;C为 ;D为 。(填写元素符号)
(2)在Y、Z二种化合物中,沸点最低的是(用化学式表示,下同) ,热稳定性最强的是 。
(3)Na2A的水溶液呈 (酸性、中性、碱性),这是因为
(用离子方程式表示)。
(4)若由A、B、C、D四种元素中的两种组成化合物,化合物中分子的空间构型为直线型。写出符合上述要求且原子数不少于3的任意三种中学常见化合物的结构式:
、 、 。
27.(18分)工业生产的纯碱中常含有少量的食盐。某学生为测定纯碱中Na2CO3的质量百分含量,设计了如图实验装置。
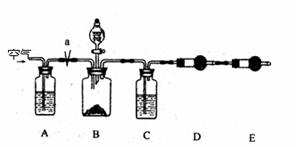
操作步骤如下:
①检查装置的气密性;
②在干燥管D、E内填满颗粒状碱石灰,称量D的总持量(W1g);
③称取一定质量的纯碱(W2g),并所它放进广口瓶B里;
④打开分液漏斗的活塞,将稀硫酸缓缓滴入B瓶中,至不再产生气体为止。
⑤打开弹簧夹a,缓缓鼓入空气约5分钟后,再称干燥管D的总质量(W3g);
(1)A瓶中盛的试剂是 ,作用是 。
(2)C瓶中盛的试剂是 ,作用是 。
(3)鼓入空气的目的是 。
(4)干燥管E的作用是 。
(5)如果去掉装置A,测定结果将(填偏大、偏小或无影响) ;如果去掉装置C,测定结果将 。
(6)计算Na2CO3的质量百分含量的算式为 。
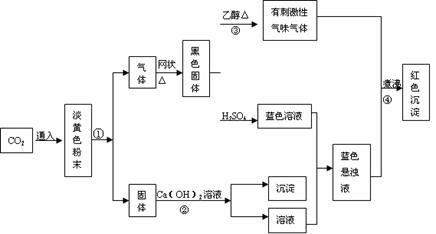
26.(15分)根据下面的转化关系和实验现象回答下列各问题。
(1)反应①中,当生成的气体在标准状况下体积为2.24L时,参加反应的淡黄色颗粒的质量为 g 。
(2)黑色固体的化学式为
(3)写出反应①、②、④的化学方程式
①
②
④
13.用相同质量的金属钠进行下列实验,产生氢气最多的是 ( )
A.将钠投入到足量的盐酸中
B.将钠投入到足量的乙醇中
C.将钠用铝箔包好,并刺有小孔,投入足量的水中
D.将钠投入足量硫酸铜溶液中
|
12.下列离子方程式书写正确的是 ( )
A.NaHSO4溶液中滴加少量Ba(OH)2溶液 H++SO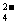 +Ba2++OH-=BaSO4↓+H2O
+Ba2++OH-=BaSO4↓+H2O
B.Ca(HCO3)2溶液中滴加少量NaOH溶液 Ca2++HCO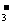 +OH-=CaCO3↓+H2O
+OH-=CaCO3↓+H2O
C.FeBr2溶液中通入过量Cl2 2Fe2++6Br-+4Cl2=2Fe3++3Br2+8Cl-
D.FeCl3溶液中通入足量H2S气体 Fe3++2H2S=FeS↓+S↓+4H+
11.在下列比较中,正确的是 ( )
A.受热稳定性:HI>HBr>HCl>HF
B.碱性:NaOH>Al(OH3)>Mg(OH)2
C.微粒半径:F-<Na+<Mg2+
D.单质的熔点:Li >Na>K>Rb
9.下列实验需要温度计,而且温度计须插入水中的是 ( )
A.银镜反应 B.石油的分馏 C.硝基苯的制取 D.实验室制乙烯

|
A.N2、H2、NH3百分含量相等
B.单位时间内,消耗amolN2的同时,消耗3amol/的H2
C.单位时间内,生成amolN2 的同时,消耗3amol的NH3
D.反应若在定容的密闭容器中进行,温度一定时,压强不随时间变化
8.已知:2H2(g)+O2(g)=2H2O(l):△H=-571.6kJ/mol
H2(g)+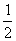 O2(g)=H2O(g);△H=-241.8kJ/mol
O2(g)=H2O(g);△H=-241.8kJ/mol
则氢气的燃烧热为 ( )
A.241.8kJ/mol B.-241.8kJ/mol C.285.8kJ/mol D.571.6kJ/mol
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com