
21.化学工业在国民经济中占有极其重要的地位,江苏省是国内最早的硫酸生产基地之一。主要方程式和主要设备: (黄铁矿的主要成分为FeS2) 4FeS2+11O2
= 2Fe2O3+8SO2 (沸腾炉) 2SO2+O2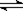 2SO3 (接触室) SO3+H2O=H2SO4(吸收塔)
2SO3 (接触室) SO3+H2O=H2SO4(吸收塔)
(1)(2分)硫酸生产中,根据化学平衡原理来确定的条件或措施有 (填写序号)。
A.矿石加入沸腾炉之前先粉碎 B.接触室的反应使用V2O5作催化剂
C.接触室中不使用很高的温度 D.净化后炉气中要有过量的空气
E.接触室中的氧化在常压下进行 F.吸收塔中用98.3%的浓硫酸吸收SO3
20.(5分)已知: 2H2(g)+O2(g)=2H2O(l) △H=-571.6 kJ·mol-1
C3H8(g)+5O2(g) = 3CO2(g) +4H2O(l) △H=-2220.0 kJ·mol-1
根据上面两个热化学方程式回答下列问题:
(1)H2的燃烧热为 .(2)1molH2和2molC3H8 组成的混合气体完全燃烧释放的热量为 。
(3)现有H2和C3H8的混合气体共5mol,完全燃烧时放热3847kJ,则在混合气体中H2和C3H8的体积比是 。
19.(6分)(1)在25℃条件下将pH=11的氨水稀释100倍后溶液的pH为__ __(填序号)。
A.9 B.13 C.11-13之间 D.9-11之间
(2)pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合后,混合溶液中
c(Na+)___________c(CH3COO-)(填“大于”、“等于”或“小于”)。
(3)如果将HCl和CH3COONa 溶液等浓度、等体积混合,则混合溶液中各离子浓度的大小关系为____________________ ____。
(4) 常温下,若NaOH溶液中的c(OH―)与NH4Cl 溶液中的c(H+)相同,现将NaOH和NH4Cl的溶液分别稀释10倍,稀释后NaOH 和 NH4Cl溶液的pH分别用pH1和pH2表示。则pH1+pH2为 (可以用“>”、“=”或“<”表示)。
18、(1)(3分)下图分别是温度计、量筒、滴定管的一部分,则:
量筒应该是 读数为 mL
滴定管应该是 ,读数为 mL
温度计应该是 ,读数是 ℃
(2)(3分)用已知浓度的盐酸滴定未知浓度的氢氧化钠溶液时,下列实验操作会引起测量结果偏高的是 。
① 用天平称量NaOH固体,将小烧杯放在右盘,砝码放在左盘,并移动游码,使之平衡。
②滴定前滴定管尖嘴有气泡,滴定后尖嘴气泡消失 ③中和滴定时,锥形瓶内有少量蒸馏水。④酸式滴定管用蒸馏水洗后,未用标准液洗。 ⑤读取滴定管终点读数时,仰视刻度线。
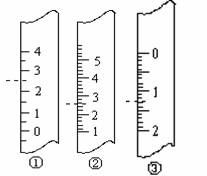
17.(10分)用50 mL0.50 mol/L盐酸与50 mL 0.55 mol/L NaOH溶液,在如图所示的装置中进行中和反应。测定强酸与强碱反应的反应热。
(1)在该实验中,量取50 mL 盐酸或NaOH 溶液,需要用到的玻璃仪器是___________。
(2)装置中大、小烧杯之间填满碎泡沫塑料的目的是______________________________。
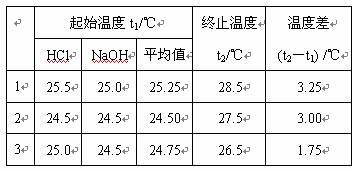
(3)某同学实验记录的数据如上表所示,其中记录的终止温度是指__________________温度。
(4)计算该实验发生中和反应时放出的热量为________________kJ(中和后生成的溶液的比热容c=4.18J/(g·℃ ,稀溶液的密度都为1g/cm3)。
(5) 如果用50 mL 0.55mol/L的氨水(NH3·H2O)代替NaOH溶液进行上述实验,通过测得的反应热计算中和热,其中和热△H会偏大,其原因是
________________________ 。
16、在373K 时,把0.5 mol N2O4气体通入体积为5 L(恒容)的真空密闭容器中,立即出现红棕色。反应进行到2 s时,NO2的浓度为0.02 mol·L-1。在60 s时,体系已达到平衡,此时容器内压强为反应前的1.6倍。下列说法正确的是( )
A.前2 s,N2O4的平均反应速率为0.01 mol·L-1·s-1
B.在2 s时,体系内压强为反应前的1.1倍
C.平衡时,体系内含NO2 为0.04 mol·L-1
D.平衡时,N2O4的转化率为60%
第Ⅱ卷(共64分)
15. 二元酸H2A在水中的电离情况是:H2A=H++HA-和HA- H++A2-,则下列物质的水溶液中粒子浓度之间存在的关系错误的是( )
二元酸H2A在水中的电离情况是:H2A=H++HA-和HA- H++A2-,则下列物质的水溶液中粒子浓度之间存在的关系错误的是( )
A.NaHA:c(Na+)>c(HA-)>c(OH-)>c(H+)
B.NaHA:c(Na+)=c(A2-)+c(HA-)+c(H2A)
C.Na2A: c(Na+)>c(A2-)>c(OH-)>c(H+)
D.H2A: c(H+)=c(HA-)+2 c(A2-)+c(OH-)
14.化学用语是学习化学的重要工具,下列表示物质变化的化学用语中,错误的是( )
A.向KHSO4溶液中滴人Ba(OH)2溶液使pH=7;
SO42- + 2H+ + Ba2+ + 2OH- = BaSO4↓ + 2H2O
B.明矾水解的离子方程式: Al3++3 H2O===Al(OH)3 ↓+3H+
C.Mg(HCO3)2 溶液与盐酸溶液反应的离子方程式:HCO3-+ H+ == CO2↑+H2O
D.常温常压下,1g氢气充分燃烧生成液态水,放出142.9 kJ热量。则表示氢气燃烧热化学方程式2H2(g)+O2(g)=2H2O(l) △H=+571.6kJ/mol
13.NH4Cl溶于重水(D2O)生成一水合氨分子和水合氢离子的化学式是( )
A. NH3 ·D2O和HD2O+ B. NH3·HDO和D3O+
C. NH2D·D2O和DH2O+ D.NH2D·HDO和D3O+
12.已知:Fe2O3(s)+3 CO(g)=2 Fe(s)+3 CO2(g);ΔH=-25kJ·mol-1
3 Fe2O3(s)+CO(g)=2 Fe3O4(s)+CO2(g);ΔH=-47kJ·mol-1
Fe3O4(s)+CO(g)=3 FeO(s)+CO2(g);ΔH=19kJ·mol-1
则CO还原FeO的热化学方程式为( )
A.FeO+CO=Fe+CO2;ΔH=+11 kJ·mol-1
B.FeO(s)+CO(g)=Fe(s)+CO2(g);ΔH=-22 kJ·mol-1
C.FeO(s)+CO(g)=Fe(s)+CO2(g);ΔH=-11 kJ·mol-1
D.FeO(s)+CO(g)=Fe(s)+CO2(g);ΔH=+22 kJ·mol-1
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com