
5.用下列实验装置完成对应的实验,操作正确并能达到实验目的的是 ( )
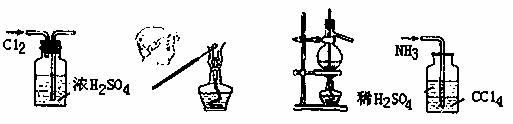
A.干燥Cl2 B.检验K2CO3中的K+ C.石油的蒸馏 D.吸收NH3
4.下列关于元素的叙述正确的是 ( )
A.目前使用的元素周期表中,最长的周期含有32种元素
B.非金属元素形成的共价化合物中,原子的最外层电子数只能是2或8
C.含有共价键的化合物一定是共价化合物
D.金属元素与非金属元素只能形成离子化合物
3.从宏观方面来说物质由元素组成,从微观方面来说物质由粒子构成。下列说法中不正确的是 ( )
A.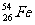 与
与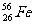 互为同位素
互为同位素
B.只由一种分子组成的物质一定为纯净物
C.质子数等于电子数的某微粒,可能是一种分子或一种离子
D.46 g NO2 和46 g N2O4 含有的原子数相等
2.下列表述正确的是 ( )
A.人造刚玉熔点很高,可用作高级耐火材料,主要成分是SiO2
B.在医疗上碳酸钠可用于治疗胃酸过多
C.用于现代通讯的光导纤维的主要成分是高纯度的硅
D.分散系中分散质粒子的直径:Fe(OH)3 悬浊液>Fe(OH)3 胶体>FeCl3 溶液
1.环境污染已成为人类社会面临的重大威胁,下列对应关系不正确的是 ( )
|
|
环境问题 |
造成环境问题的主要物质 |
|
A |
酸雨 |
二氧化硫 |
|
B |
温室效应 |
二氧化碳 |
|
C |
白色污染 |
二氧化硅 |
|
D |
光化学烟雾 |
二氧化氮 |
25.(7分) 将4mol SO2与2molO2放入4L的密闭容器中,在一定条件下反应达到平衡:
2SO2 (g) +
O2 (g)  2SO3(g) 测得平衡时混合物总的物质的量为5mol,求:
2SO3(g) 测得平衡时混合物总的物质的量为5mol,求:
(1)平衡时各物质的浓度;(2)该温度下的平衡常数;(2)平衡时SO2的转化率。
24、 (8分)在某一容积为2L的密闭容器内,加入0.8mol的H2和0.6mol的I2,在一定的条件下发生如下反应:
H2(g) + I2(g) 2HI(g)
(8分)在某一容积为2L的密闭容器内,加入0.8mol的H2和0.6mol的I2,在一定的条件下发生如下反应:
H2(g) + I2(g) 2HI(g)  H<0反应中各物质的浓度随时间变化情况如图1:
H<0反应中各物质的浓度随时间变化情况如图1:
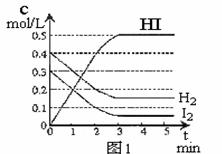
(1)该反应的化学平衡常数表达式为 。
(2)根据图1数据,反应开始至达到平衡时,平均速率v(HI)为 。
(3)反应达到平衡后,第8分钟时:
①若升高温度,化学平衡常数K (填写增大、减小或不变)
HI浓度的变化正确的是 (用图2中a-c的编号回答)
②若加入I2,H2浓度的变化正确的是 ,(用图2中d-f的编号回答)
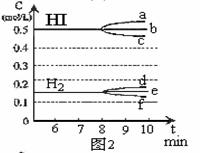
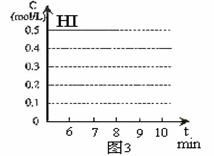
(4)反应达到平衡后,第8分钟时,若反容器的容积扩大一倍,请在图3中画出8分钟后HI浓度的变化情况。
23、(7分)工业上制取CuCl2的生产流程如下:
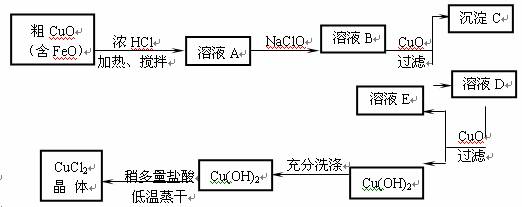
请结合下表数据,回答下列问题:
|
物 质 |
Fe(OH)2 |
Cu(OH)2 |
Fe(OH)3 |
|
溶度积/25℃ |
8.0×10-16 |
2.2×10-20 |
4.0×10-38 |
|
完全沉淀时的pH范围 |
≥9.6 |
≥6.4 |
3-4 |
⑴ 向含有等浓度Fe2+、Cu2+、Fe3+的混合溶液中滴加NaOH溶液,最先生成的沉淀是 。
⑵ 溶液A中加入NaClO的目的是 。
⑶ 在溶液B中加入CuO后过滤,这次过滤控制的条件是 。
⑷ 在Cu(OH)2加入盐酸使Cu(OH)2转变为CuCl2。采用多量盐酸和低温蒸干的目的是 。
22、(7分)
(1)25℃时, 0.05mol/LH2SO4溶液的PH=_________;0.05mol/LBa(OH)2溶液C(H+)=____ ___
(2)某温度下纯水中的C(H+)= 2×10-7mol/L,则此时溶液中的C(OH-)= ;若温度不变,滴入稀盐酸,使C(H+)= 5×10-4mol/L,则溶液中C(OH-)= ,此时溶液中由水电离产生的C(H+)= 。
(3)已知100℃时,KW=1×10-12.在该温度下,将100ml0.001 mol/L的NaOH溶液加水稀释至1L,则该溶液的PH为 。
0.(2)(6分)1mol/L的NaHSO3溶液中,有关粒子浓度由大到小的顺序为:
c (Na+)>c (HSO3-)>c (SO32-)>c (H2SO3)
①该溶液中c (H+) c (OH-)(填“>”、“=” 或“<” ),其理由是(用离子方程式表示): 。
②现向NaHSO3溶液中,逐滴加入少量含有酚酞的NaOH溶液,可观察到的现象是 ,反应的离子方程式为: 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com