
16.(8分)三氟化氮(NF3)是一种无色、无味的气体,它是微电子工业技术创新必不可少的关键原料之一,可由氨气和氟气反应得到:4NH3+3F2 = NF3+3NH4F。则:
(1)上述反应中,氧化剂与还原剂的物质的量之比为_________;若反应中有0.5 mol NH3 被氧化,转移电子的数目为 。
(2)在潮湿的空气中,NF3 能与水蒸气发生氧化还原反应,其反应的产物有:HF、NO和HNO3 ,则在NF3、F2 、NO三种气体中,氧化性由弱到强的顺序为
。
(3)一旦NF3 在空气中泄漏,还是易于发现。你判断该气体泄漏时的现象是
。
15.(8分)今有一混合物的水溶液,只可能含有以下离子中的若干种:K+、H+、 I-、Mg2+、Ba2+、SO42-、CO32-、NO3-,现取二份各100 mL溶液进行如下实验:
①第一份加足量NaHCO3 溶液加热后,收集到气体0.05 mol
②第二份加足量Ba(NO3)2 溶液充分反应后过滤干燥,得沉淀4.66 g。
根据上述实验回答
(1)溶液中一定不存在的离子是 ;
(2)溶液中可能存的离子是 ;
(3)请写出溶液中一定存在的阴离子的物质的量浓度 。
14.(9分)
(1)一定温度下,把相对分子质量为M的可溶性盐Wg溶解在VmL水中,恰好形成饱和溶液(密度为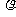 g·cm-3),则溶质质量分数为
,物质的量浓度为
,该温度下此盐的溶解度为
。
g·cm-3),则溶质质量分数为
,物质的量浓度为
,该温度下此盐的溶解度为
。
(2)粗盐经提纯后得到NaCl溶液,再经蒸发、结晶、烘干得精盐。
①蒸发操作中使用到的仪器除铁架台(带铁圈)外,还需要仪器的名称为 。
②该同学将所得精盐配成溶液,用于另一实验。实验中需要用60 mL,1 mol/L-1的NaCl溶液,配制过程中用托盘天平称取的精盐质量为 ,配制该溶液所需的主要仪器是 。
13.(6分)用于分离提纯物质的方法有多种,请根据下列实验要求填空:
(1)分离饱和食盐水和泥沙的混合物,分离方法为 ,所用的玻璃仪器有
。
(2)分离相溶的CCl4(沸点76.75℃)和甲苯(沸点110.6℃)的混合物,分离方法为 。
(3)从碘水里提取并得到固体碘,应先进行 操作,再进行 操作。
12.足量铜与一定量浓硝酸反应得到硝酸铜溶液和NO2、N2O4、NO 的混合气体,这些气体与0.84 L O2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸。若向所得硝酸铜溶液中加入3 mol•L-1 NaOH溶液至Cu2+ 恰好完全沉淀,则消耗NaOH溶液的体积是 ( )
A.45mL B.50mL C.30mL D.60mL
|
11.第三周期元素X,它的原子核外最外层实现8电子稳定结构所需的电子数小于次外层和最内层的电子数之差,且等于最内层电子数的整数倍。下列说法正确的是 ( )
A.X元素最高价氧化物对应的水化物一定是强酸
B.X元素的氢化物化学式一定为H2X
C.X元素在常温下稳定存在的氧化物一定能与烧碱反应
D.X的单质一定是良好的半导体材料
9.用NA表示阿伏加德罗常数的值,下列说法正确的是 ( )
A.4 g重水(D2O)中所含质子数为0.2 NA
B.1 L 0.5 mol•L CH3COONa溶液中含有的CH3COO-个数为0.5 NA
C.12.5 mL 16 mol•L-1 浓硫酸与足量铜反应,转移电子数为0.2 NA
D.在标准状况下,V L CO 和NO的混合气体中含有的氧原子个数为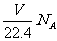
|
|
|
X |
Y |
X |
|
A |
氧化物 |
化合物 |
纯净物 |
|
B |
电解质 |
离子化合物 |
化合物 |
|
C |
胶体 |
分散系 |
混合物 |
|
D |
碱性氧化物 |
金属氧化物 |
氧化物 |
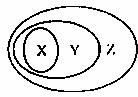
8.利用下列各组的物质问反应制备和收集少量相应气体,能采用右图实验装置的是( )
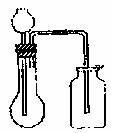 ①浓氨水与固体NaOH
①浓氨水与固体NaOH
②H2O2 溶液与二氧化锰
③稀硝酸与铜片
④方解石与稀盐酸
⑤电石与水
⑥二氧化锰与浓盐酸
A.①⑤ B.②④ C.④⑥ D.③⑤
7.下列离子方程式中正确的是 ( )
A.过量的NaHSO4与Ba(OH)2溶液反应:Ba2++2OH-+2H++SO42-= BaSO4↓+2H2O
B.NH4HCO3 溶液与过量NaOH溶液反应:NH4++OH- = NH3↑+H2O
C.次氯酸钙溶液中通入少量二氧化碳:2ClO-+CO2+H2O = 2HClO+CO32-
D.FeBr2 溶液中通入过量Cl2:2Fe2++2Br-+2Cl2 = 2Fe3++Br2+4Cl-
6.对于某些离子的检验及结论一定正确的是 ( )
A.加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,一定有CO32-
B.加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42-
C.加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝,一定有NH4+
D.加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,一定有Ba2+
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com