
7.a mol NaOH溶液逐滴加入b molA1C13溶液中,沉淀逐渐增多,后又逐渐减小,但最终仍有沉淀剩余,则剩余沉淀的物质的量为 ( )
A.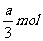 B.hmol
B.hmol
C.(4b-a)mol D.(4a-b)mol
6.下列有关说法正确的是 ( )
A.114号元素可能是非金属元素
B.非金属元素的最外层电子数一定不小于其电子层数
C.非金属元素R可以形成含氧酸HnROh,则R元素的最低价一定为-(8+a-2h)
D.最外层电子数为2的元素只可能是HA或O族元素
5.下列实验操作完全正确的是 ( )
|
编号 |
实验 |
操作 |
|
A |
钠与水反应 |
用镊子从煤油中取出金属钠,切下绿豆大小的钠,小心放入装满水的烧杯中 |
|
B |
配制一定浓度的KC1溶液1000mL |
准确称取KC1固体,放入到1000mL的容量瓶中,加水溶解,振荡摇匀定容 |
|
C |
除去A1C13溶液中混有的MgC12 |
向溶液中加入过量NaOH溶液,过滤后向滤液中加入适量盐酸 |
|
D |
检验Fe2+的存在 |
在溶液中先加入KSCN溶液,无明显现象,再加入氯水,溶液变血红色 |
4.向饱和澄清石灰水中加入生石灰,再恢复到原温度,下列说法正确的是 ( )
A.Ca2+浓度减小 B.溶剂质量减小
C.溶液质量不变 D.Ca2+数目增多
3.下列离子方程式正确的是 ( )
A.过量铁粉溶于稀HNO3中:Fe+NO3-+4H+=Fe3++NO↑+2H2O
B.过量NaHSO4溶液加入到Ba(OH)2溶液中:2H++SO42-+Ba2++2OH-=2H2O+BaSO4↓
C.少量C12通入FeBr2溶液中:2Br-+C12=2C1-+Br2
D.少量A1C13溶液滴入到氨水中:A13++4NH3·H2O=A1O2-+4NH4++2H2O
2.用NA表示阿伏加德罗常数的值,下列说法正确的是 ( )
A.H2O2中加入MnO2,当产生0.1molO2时转移电子数为0.4NA
B.10gNH4+中含有的电子数为NA
C.11.2LNO2和N2O4的混合气体含有的分了数为0.5NA
D.25℃、101Pa时,16gO4中含有的原子数为NA
1.碳酸钠俗名纯碱或苏打,在外观上与食盐相似,可以作家用洗涤剂,如清洗厨房用具的油污等。下列不能将加碘食盐和碳酸钠区别开的试剂或用品是 ( )
A.食醋 B.淀粉 C.pH试纸 D.酚酞试液
19.(12分)在实验室中拟用氧化铜、稀硫酸和锌来制取纯净的铜并验证铜的有关性质,甲、乙两位同学分别设计了如下实验方案。
甲:①CuO溶于适量稀硫酸中;
②在①的溶液中加入适量锌,反应一段时间后,过滤、烘干,即得纯净的铜。
乙:①锌与稀硫酸反应得氢气;
②将氢气通过氧化铜中并加热,充分反应一段时间后即得纯净的铜。请填空:
(1)丙同学发现上述两方案制得的铜都含有杂质,则甲、
乙方案制得的铜所含杂质分别是 和 。
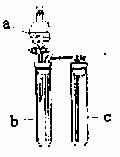 (2)现欲用乙方案制得纯净的铜,你认为应怎样补充完善方案,简述操作步骤 。
(2)现欲用乙方案制得纯净的铜,你认为应怎样补充完善方案,简述操作步骤 。
(3)现用制得的纯净的铜进行如下实验,如右图在c中加适量NaOH溶液,b中放适量制得的铜,由分液漏斗a向b中加入2 mL稀硝酸,则b中反应的离子方程式是 ,实验中观察到的现象是 。
18.(10分)已知A、B、C、D、E为中学化学中的常见化合物,甲、乙、丙为短周期中的非金属单质,丁为金属单质,C的焰色反应呈黄色,丙是氯碱工业的重要产物。它们之间的相互转化关系如下(有的反应部分产物已经略去)
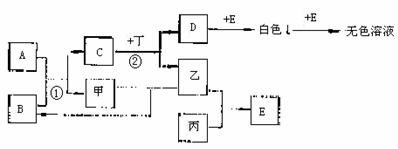
(1)甲的化学式为 ;
(2)丙在周期表中的位置为 ;
(3)反应①、②的化学方程式分别为:
反应① ; 反应② ;
(4)写出C跟丙反应的离子方程式 。
17.(11分)A、B、C、D、E、F六种短周期主族元素,原子序数依次增大。其中B的单质在常温下为双原子分子,它与A可形成分子X,X的水溶液呈碱性;D的简单阳离子与X具有相同电子数,且D是同周期中简单离子半径最小的元素;E元素的原子最外层比次外层少两个电子,C、F两种元素的原子最外层共有13个电子。则
(1) B的原子结构示意图______________;
(2)B、C、E与A形成的化合物中最稳定的 (写化学式);
(3)C与D形成的化合物的化学式是______ ____,它的性质决定了它在物质的分类中应属于______ ______;请写出该化合物的水化物的电离方程式 ;
(4)F的单质在反应中常作 剂,该单质的水溶液与E的低价氧化物反应的离子方程式为 ;
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com