
24.(14分)学习元素周期律后,某研究性学习小组的同学们对第四周期过渡元素的氧化物产生了浓厚的兴趣。在已知二氧化锰对氯酸钾催化分解知识的基础上,联想到氧化铁、氧化铜、氧化铬等对氯酸钾的分解是否有催化作用,对此他们进行了实验研究。
请根据要求完成下列部分实验报告:
(1)课题名称: 。
(2)实验仪器及试剂:
实验仪器:带铁夹的铁架台、带橡皮塞的导管、量气装置、过滤装置、电子天平、药匙、 等。
实验试剂:二氧化锰、氧化铁、氧化铜、氧化铬和氯酸钾
(3)实验步骤:略
(4)实验数据:
|
实验 编号 |
KC1O3/g |
氧化物 |
产生气体/mL (已折算到标况) |
耗时/s |
||
|
化学式 |
质量/g |
回收 |
||||
|
1 |
0.60 |
- |
- |
- |
10 |
480 |
|
2 |
0.60 |
MnO2 |
0.20 |
90% |
67.2 |
36.5 |
|
3 |
0.60 |
CuO |
0.20 |
90% |
67.2 |
79.5 |
|
4 |
0.60 |
Fe2O3 |
0.20 |
90% |
67.2 |
34.7 |
|
5 |
0.60 |
Cr2O3 |
0.20 |
90% |
67.2 |
188.3 |
(5)实验讨论:
①在氧化物的回放过程中,要进行的操作是溶解、 、洗涤、 、称量。
②实验编号3的实验中KC1O3的分解率为 (保留一位小数)。
③在和Cr2O3做研究实验时,发现有刺激性气味的气体产生,同时绿色的混合物变成了橘黄色。该刺激性气味的气体是 ,可用 试纸检验。上述异常现象产生的原因是 。
(6)实验结论 。
23.(14分)现有A、B、C、D、F六种短周期元素,在化学反应中均能形成简单的阴离子或阳离子,且A、B、C、D离子具有相同的电子层结构。
已知:①常温下,F的单质是一种有色气体,常用于杀菌、消毒;
②A的单质以溶于NaOH溶液,向生成的溶液中通入CO2气体有白色沉淀生成;
③C的氢化物分子G是具有10电子微粒,且以发生下列转化

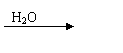
G P Q M+P
④E和D是同一主族的元素,二者能形成微粒的个数比为1:2和1:3的化合物T和K;
⑤B和D可形成微粒个数比为1:1和2:1的离子化合物X和Y。
请回答下列问题:
(1)B元素的名称是 ;
(2)E元素的原子结构示意图是 。
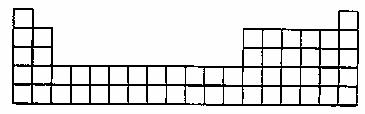
(3)请将A、C的元素符号填在如图所示部分元素周期表的适当位置上。
(4)G的电子式为 。化合物X所含化学键类型有 。
(5)T与F单质的水溶液反应的离子方程式为 ;
G与D的单质反应的化学方程式为 ;
M与铜反应的化学方程式为 。
22.(12分)燃料和能源是化学知识与社会生活联系极为密切的内容。我们要关注矿物能源的合理利用,积极研究、开发新能源。
(1)新能源应该具有原状料易得、燃烧时产生的热量多且不会污染环境特点。在煤炭、石油、煤气、氢气中,前途广阔的能源是 。
(2)近年来,我国煤矿事故大多是由于瓦斯暴炸所致。瓦斯中含有甲烷和一氧化碳等气体,当矿井中瓦斯浓度达到一定范围时遇明火即燃烧爆炸。为避免灾难的发生应采取的切实可行的措施有 (填序号)
①加强安全管理,杜绝明火源 ②降低瓦斯气体的着火点
③提高通风能力 ④将矿井中的氧气抽去
(3)为了提高煤的热效应,同时减少燃烧时的环境污染,常将煤转化为水煤气,这是将煤转化为洁净燃料的方法之一。水煤气的主要成分是一氧化碳的氢气,它是由煤炭和水蒸气反应制得,已知C(石墨)、CO、H2燃烧的热化学方程式为:
C(s,石墨)+O2(g) CO2(g)△H1=-393.5kJ·mol-1
H2(g)+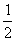 O2(g)
O2(g) H2O(g)△H2=-241.8kJ·mol-1
CO(g)+O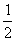 2(g)
2(g) CO2(g)△H3=-283.0kJ·mol-1
H2(g)+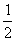 O2(g)
O2(g) H2O(1)△H4=-285.8kJ·mol-1
请回答下列问题:
①根据上述提供的热化学方程式计算,36g水由液态变成气态的热量变化是 。
②写出C(s,石墨)与水蒸气反应的热化学方程式 。
③丙烷是液化石油气的主要成分之一,丙烷燃烧的热化学方程式为:
C3H8(g)+5O2(g) 3CO2(g)+4H2O(g)△H=-2220.0kJ·mol-1
相同物质的量的丙烷和一氧化碳完全燃烧生成气态产物时,产生的热量之比为 ;相同质量的氢气和丙烷完全燃烧生成气态产物时,产生的热量之比为 。
21.(12分)右图是一个化学过程的示意图。已知甲池的总反应式为:
|
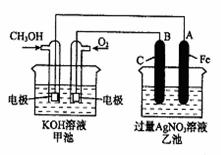
2CH3OH+3O2+4KOH 2K2CO3+6H2O
(1)请回答图中甲、乙两池的名称。
甲电池是 装置,乙池是 装置。
(2)请回答下列电极的名称:
通入CH3OH的电极名称是 ,
B(石墨)电极的名称是 。
(3)写出电极反应式:
通入O2的电极的电极反应式是 。
A(Fe)电极的电极反应式为 ,
(4)乙池中反应的化学方程式为 。
(5)当乙池中A(Fe)极的质量增加5.40g时,甲池中理论上消耗O2 mL(标准状况下)
21.(11分)用脱脂棉包住约0.2g过氧化钠粉末,置于石棉网上,向脱脂棉上滴水,观察到脱脂棉剧烈燃烧起来。
(1)由上述实验现象所得到的有过氧化钠跟水反应的结论是:
第一,为氧气生成,
第二, 。
Na2O2跟水反应的化学方程式是 。
(2)某研究性学习小组拟用下图所示装置(气密性良好)进行实验,以证明上述结论。
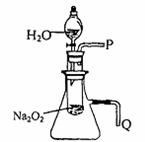
用以验证第一条结论的实验操作及现象是:
。
用以验证第二条结论的实验操作及现象是:
。
(3)实验(2)向试管中加水至固体完全溶解且不再有气泡生成后,取出度管,向试管中滴入酚酞试液,发现溶液先变红后退色,为探究其原因,该小组同学从查阅有关资料中得知:Na2O2与水反应可生成H2O2,H2O2具有强氮化性的漂白性。
请设计一个简单的实验,验证Na2O2跟足量水充分反应后的溶液中有H2O2存在。(只要求写出实验所用的试剂及观察到的现象)
试剂: ;
现象: 。
(4)该小组同学提出用定量的方法探究Na2O2跟水反应后的溶液中是否含有H2O2,其实验方法为:称取2.6gNa2O2固体,使之与足量的水反应,测量产生O2的体积并与理论值比较,即可得出结论:
①测量气体体积时,必须持试管和量筒内的气体都冷却至室温时进行,应选用如图装置中的(忽略导管在量筒中所占的体积) (填序),理由是 。
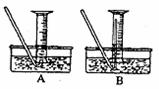
②若在标准状况下测量气体的体积,应选用的量
筒的大小规格为 (选填“100mL”、“200mL”、“500mL”或“1000mL”)
19.(15分)某课外活动小组用如图所示的实验装置探究氯气与氨气之间的反应。其中A、F为氨气和氯气的发生装置,C为纯净、干燥的氯气与氨气反应的装置。
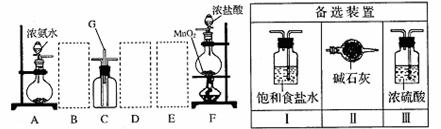
请回答下列问题:
(1)装置F中发生反应的离子方程式是 。
(2)装置A中的烧瓶内固体可选用 (选填以下选项的代号)。
A.碱石灰 B.浓硫酸 C.生石灰 D.五氧化二磷 E.烧碱
(3)虚线框内应添加必要的除杂装置,请从右图的备选装置中选择,并将编号填入下列空格。B 、D 、E 。
(4)氯气和氨气在常温下混合就能发生反应生成氯化铵和氮气,该反应的化学方程式为: ;装置C内出现浓厚的白烟并在容器内壁凝结,请设计一个实验方案鉴定该固体就是氯化铵: 。
(5)若从装置C和G处逸出的尾气中含有N2和少量C12,应如何处理?
。
18.下列说法中,正确的是 ( )
①食盐灼烧时火焰呈黄色与久置的浓硝酸呈黄色原理不相同
②固体氢氧化钠存入在带塑料塞的广口瓶中
③熔点:钾>钠>钠钾合金
④向紫色石蕊试液中加入过量的Na2O2粉末,振荡后溶液呈蓝色
⑤向含有Na+、SO42-、HCO3、CO32-的溶液中加入过量的Na2O固体,Na+和CO32-的物质的量不变
A.①② B.①②③ C.①②④ D.①②④⑤
|
可能用到的相对原子质量:H:1 C:12 Na:23 C1:35.5 K:39 Mn:55 Ag:108
17.下列反应的离子方程式书写不正确的是 ( )
A.浓烧碱溶液中加入铝片:2A1+2OH-+H2O=[A1(OH)4]-+H2↑
|
B.以石墨作为电极电解氯化钠溶液:2C1-+2H2O 2OH-+H2↑+C12↑
C.硫酸亚铁溶液与稀硫酸、双氧水混合:2Fe2++H2O2+2H+ 2Fe3++2H2O
D.氢氧化钠溶液中通入过量CO2气体:CO2+2OH- CO32-+H2O
16.一定条件下,在容积为10L的密闭容器中,1molX和1molY进行如下反应:
 2X(g)+Y(g) Z(g)经60s达到平衡,生成0.3molZ,下列说法正确的是( )
2X(g)+Y(g) Z(g)经60s达到平衡,生成0.3molZ,下列说法正确的是( )
A.以X浓度变化表示的反应速率为0.001mol/(L·s)
B.将容器容积变为20L,Z的平衡浓度为原来的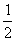
C.若增大夺强,则正反应速率增大,逆反应速率减小
D.若升高温度,X的体积分数增大,则该反应的△H>0
15.2005年11月,成功登陆“土卫六”的“惠更新”号探测器发回了数百张照片和大量数据。分析指出“土卫六”“酷似地球经常下雨”,不过“雨”的成分是液态甲烷。下列关于“土卫六”的说法中,错误的是 ( )
A.“土卫六”上存在有机物
B.“土卫六”表面温度很高
C.“土卫六”上可能存在液态水
D.“土卫六”上形成了甲烷的气液循环系统
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com