
2.化学与生活密切相关,下列有关说法正确的是 ( )
A.用米汤检验含碘盐中的碘酸钾
B.生理盐水的浓度为0.9%
C.“低钠盐”就是氯化钠中加入一定量的氯化钼,降低钠元素的含量
D.家庭可以用明矾将自来水净化成纯净化
1.2001年美国的IBM公司制造出了第一批纳米碳晶体管,发明了利用电子波性来传递信息的“导线”。下列有关纳米碳的说法正确的是 ( )
A.纳米碳是一种新型高分子化合物
B.纳米碳的化学性质很稳定
C.纳米碳的结构和化学性质与金刚石相同
D.纳米碳的导电过程属于化学变化
30.将Na2O2与NaHCO3的均匀混合物粉末分成等质量的两份,其中一份加入100mL盐酸使其充分反应,溶液呈中性,放出气体2.24L(标准状况);将生成的气体通入另一份混合物中充分反应后,气体体积变为2.016L(标准状况)。求:
(1)混合物中Na2O2和NaHCO3的物质的量之比
(2)加入盐酸的物质的量浓度。
29.为了测定氢氧化钠固体混合物m g中碳酸钠的质量分数,某探究活动小组分别设计了如下实验方案:
(1)甲同学用如图一所示装置,通过测定放出CO2的体积来确定碳酸钠的质量分数,结果误差较大,请你提出改进措施 ;
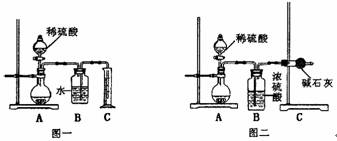
(2)乙同学用图二所示装置,通过测定反应放出CO2的质量来确定碳酸钠的质量分数,他重复正确操作三次,结果数据出现了较大偏差。你认为主要原因可能是(任写两个)
①
②
(3)丙同学认为上面的测定方法误差都较大,提出用中和滴定来测定。方法是:准确称取氢氧化钠样品m g,放入锥形瓶中加蒸馏水溶解,加1-2滴酚酞指示剂,用物质的量浓度为c mol·L-1的HCl溶液滴定至溶液由红色至无色(指示CO32-+H+=
HCO3-反应的终点),消耗HCl溶液体积为V1mL,再加入1-2滴甲基橙指示剂,继续用HCl溶液滴定至溶液由黄变橙(指示H++HCO3-=CO2↑+H2O反应的终点),又消耗HCl溶液体积为V2ml。则烧碱样品中Na2CO3的质量分数为 ;
(4)请你设计另外一个简单的实验方案来测定NaOH固体混合物中Na2CO3的质量分数。
①写出操作步骤
②用测得的数据(用字母表示)写出质量分数的表达式 。
28.(16分)A、B、C、D、E均为可溶于水的固体,组成它们的离子有
|
阳离子 |
NH4+、Ag+、Mg2+、Ba2+、Al3+ |
|
阴离子 |
Cl-、OH-、NO3-、CO32- |
分别取它们的水溶液进行实验,结果如下:
①A溶液与B、C、D溶液反应最终均生成白色沉淀;
②C溶液与D溶液反应生成白色沉淀,同时放出无色气体;
③D溶液与适量E反应生成白色沉淀,加入过量E溶液,白色沉淀消失。
(1)据此推断它们是(填化学式)
A ;B ;C ;D ;E ;
(2)写出下列反应的离子方程:
①C溶液与E溶液在加热条件下反应 ;
②过量E溶液与D溶液反应 ;
27.(18分)下图表示的反应关系中,部分产物被略去,已知2mol白色固体粉末X受热分
解,恢复到室温生成A(白色固体)、B、C各1mol,X、E、G的焰色反应均为黄色。
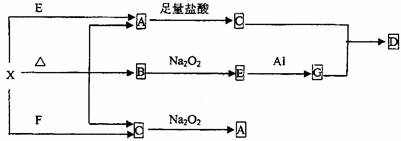
回答下列问题:
(1)写出下列物质的化学式:X ,G ,D ;
(2)写出G与C反应生成D的离子方程式 ;
(3)写出X+E→A的离子方程式 ;
(4)写出C与Na2O2反应的化学方程式 ;
若有0.2mol Na2O2参加反应,则转移的电子数为 。
26.(11分)氧化还原反应中实验上包含氧化和还原两个过程。下面是一个还原过程的反应式:NO3-+4H++3e-→NO↑+2H2O;KMnO4、Na2CO3、Cu2O、Fe2(SO4)3四种物质中的一种物质(甲)能使上述还原反应过程发生。
(1)写出并配平该氧化还原反应的离子方程式:
(2)反应中硝酸体现了 和 性质。
(3)反应中若产生0.5mol气体,则转移电子的物质的量是 mol
(4)若1mol甲与某浓度硝酸反应时,和(1)反应相比被还原硝酸的物质的量增加,原因是: 。
25.(6分)由氢气和氧气反应生成1mol水蒸气放热241.8kJ,写出该反应的热化学方程式
;若1g水蒸气转化成液态水放热2.4kJ,则氢气的燃烧热为 。
24.某干燥粉末可能由Na2O、Na2O2、Na2CO3、NaHCO3、NaCl中的一种或几种组成。将该粉末与足量的盐酸反应,有气体X逸出,X通过足量的NaOH溶液后体积缩小(同温,同压下测定)。若将原来混合粉末在空气中用酒精灯加热,也有气体放出,且剩余固体的质量大于原混合粉末的质量,下列判断正确的是 ( )
A.粉末中一定有Na2O,Na2O2,Na2CO3
B.粉末中一定不含有Na2CO3和NaCl
C.粉末中一定不含有Na2O和NaCl
D.无法肯定粉末里是否含有Na2CO3和NaCl
|
23.2008年北京奥运会“祥云”奥运火炬所用环保型燃料丙烷(C3H8),悉尼奥运会所用火炬燃料为65%丁烷(C4H10)和35%丙烷,已知丙烷的燃烧热为:2221.5kJ/mol;正本烷的燃烧热为:2878kJ/mol;异丁烷的燃烧热为:2869.6kJ/mol下列有关说法正确的是( )
A.奥运火炬燃烧时的能量转化主要是化学能转变为热能
B.相同质量的正丁烷和丙烷分别完全燃烧,前者需要的氧气多产生的热量也多
C.正丁烷比慢丁烷稳定
D.丙烷燃烧的热化学方程式可表示为:C3H8+5O2=3CO2+4H2O;△H=-2221.5kJ/mol
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com