
2.某主族元素R的最高正价与最低负化合价的代数和为4,由此可以判断 ( )
A.R气态氢化物化学式为H2R
B.R一定是IVA族元素
C.R的气态氢化物比周期其他元素气态氢化物稳定
D.R一定是第四周期元素
1.下列物质放置在空气中因发生氧化还原反应而变质的是 ( )
A.NaOH B.Na2O C.Na D.CaO
20.(12分)某研究性学习小组对铝热反应实验展开研究。对“铝热反应”的现象有这样的
描述:“反应放出大量的热,并发出耀眼的光芒”、“纸漏斗的下部被烧穿,有熔融物落入沙中”。已知,Al、Al2O3、Fe、Fe2O3熔点、沸点数据如下:
|
物质 |
Al |
Al2O3 |
Fe |
Fe2O3 |
|
熔点/℃ |
660 |
2054 |
1535 |
1462 |
|
沸点/℃ |
2467 |
2980 |
2750 |
- |
Ⅰ.(1)某同学推测,铝热反应所得到的熔融物应是铁器合金。理由是: ____ 。
(2)设计一个简单的实验方案,证明上述所得的块状熔物中含有金属铝。该实验所用的试剂是 ,反应的离子方程式为 。
(3)实验室溶解该熔融物,下列试剂中最好的是 (填序号)
A.浓硫酸 B.稀硫酸 C.稀硝酸 D.浓硝酸 E.氢氧化钠溶液
Ⅱ.实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低。某同学取一定量上述的熔融物与一定量很稀的硝酸充分反应,反应过程中无气体放出。在反应结束后的溶液中,逐滴加入4mol·L-1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示。试回答下列问题:

(1)图中OC段没有沉淀生成,此阶段发生反应的离子方程式为
(2)在DE段,沉淀的物质的量没有变化,则此阶段发生反应的离子方程式为
,上述现象说明溶液中结合OH-的能力最弱的阳离子是 。(填离子符号)。
(3)B与A的差值为 mol。
(4)B点对应的沉淀的物质的量为 mol,C点对应的氢氧化钠溶液的体积为
mL.
19.(9分)t℃时,将3mol A和1mol B气体通入体积为2L的密闭容器中(容积不变),发
 生如下反应:3A(g)+B(g) xC(g),△H<0;在2min时反应达到平衡状态(温度不变)剩余了0.8molB,并测得C的浓度为0.4mol·L-1,请填写下列空白:
生如下反应:3A(g)+B(g) xC(g),△H<0;在2min时反应达到平衡状态(温度不变)剩余了0.8molB,并测得C的浓度为0.4mol·L-1,请填写下列空白:
(1)从开始反应至达到平衡状态,生成B的平均反应速率为 。
(2)x= ,平衡常太K= 。
(3)若继续向原平衡混合物的容器中通入少量氦气(假设氦气和A、B、C都不反应)后,化学平衡(填字母) 。
A.向正反应方向移动 B.向逆反应方向移动 C.不移动
(4)若向原平衡混合物的容器中再充入a mol C,在t℃时达到新的平衡,此时B的物质的量为n(B) mol,平衡常数k 。(增大、减小、不变)
(5)如果上述反应在相同温度和容器中进行,欲使反应达到平衡时C的物质的量分数与原平衡相等,起始加入的三种物质的量n(A)、n(B)、n(C)之间应该满足的关系式为 。
18.(17分)A、B、C、D、E五种短周期元素,它们的原子序数依次增大;A元素是原子半径最小的原子;B元素的最高价氧化物对应水化物与其氢化物生成一种盐X;D与A同主族,且与E同周期;E元素的最外层电子数是其次外层电子数的3/4,A、B、D、E这四种元素,每一种与C元素都能形成元素的原子个数比不相同的若干种化合物。请回答下列问题:
(1)C和E两元素相比较,非金属性较强的是 (填元素名称),可以验证该结论的是 (填写编号);
A.比较这两种元素的气态氢化物的沸点
B.比较这两种元素的原子的电子层数
C.比较这两种元素的气态氢化物的稳定性
D.比较这两种元素的单质与氢化合的难易
(2)C、D两元素形成的原子个数比为1:1的化合物与C、E两元素形成的两种化合物都能反应,且有一种共同的产物,写出这两个反应的化学方程式:
; 。
(3)A、B、C、E四种元素可形成两种酸式盐,两种酸式盐相互反应的离子方程式为 ,X的水溶液呈 性,原因是(用离子方程式表示) 。
(4)A、C、E间可形成甲、乙两种微粒,它们均为负一价双原子阴离子,且甲有18个电子,乙有10个电子,则甲与乙反应的离子方程式为 ;
(5)D元素的气态氢化物和其低价氧化物能反应生成D的单质,该反应中氧化产物与还原产物的物质的量之比为 。
(6)①在火箭推进器中装有液态B2A4和液态A2C2,已知0.4mol.液态B2A4和足量液态A2C2反应,生成气态B2和气态A2C,放出256.6kJ的热量。试写出该反应的热化学方程式: 。
 ②B2A4又称为肼,是一种可燃性液体,肼一空气燃料电池是一种碱性燃料电池,电解质溶液是20%-30%的KOH溶液,该电池放电时的电极反应式为:正极 ,负极
。
②B2A4又称为肼,是一种可燃性液体,肼一空气燃料电池是一种碱性燃料电池,电解质溶液是20%-30%的KOH溶液,该电池放电时的电极反应式为:正极 ,负极
。
右图是一个电化学过程示意图。
1)锌片上发生的电极反应式为 。
2)假设使用肼一空气燃料电池作为本过程中的电源,铜片的质量变化为128g,则肼一空气燃料电池理论上消耗标准状况下的空气 L(假设空所中氧气体积含量为20%)。
17.(14分)
Ⅰ.化学是一门以实验为基础的自然科学,化学实验在化学学习中具有极其重要的作用。
(1)下列关于实验的叙述正确的是 。
A.燃着的酒精灯不慎碰翻失火,应立即用湿布盖灭
B.在两支试管里分别加热NH4Cl和NH4HCO3,现象完全相同
C.在铝热反应的实验中,用滤纸做的漏斗必须干燥
D.用滴有酚酞的水做氨的喷泉实验,只验证了氨的溶解性
E.验证CO2中混有SO2时,可将混俣气体通过品红溶液
(2)下列实验装置没有错误的一项是 。

Ⅱ.实验室可以通过三条途径按不同要求来制取氮:
①加热条件下用NH3还原CuO制得纯净的N2和活性铜粉;
②将空气通过灼热的活性铜粉制得较纯净的N2;
③加热NaNO2(一种致癌物质,有剧毒)与NH4Cl的混合浓溶液制取N2。
如图所示,给出了按上述途径制N2的可供选择的几种实验仪器,其他必要的仪器如铁架台、铁夹、铁圈、石棉网、酒精灯等未列出。

(1)按途径①制取N2时所需的氨气要用浓氨水与生石灰作原料制取,最好要用上述仪器中的 (填仪器代码,下同)作为氨气发生装置,该反应的化学方程式为 。要制取并收集纯净的N2(允许含少量的水范气),还应使用到上述仪器中的 (按气流从左到右的顺序列出)。
(2)按途径②制取N2,原料气空气是通过向 (填上述仪器代码)中加入
而送入反应器的,反应器内发生的现象是 。
(3)上述三种制取N2的途径,①和②两条途径常常被协同使用而越来越受到人们的关注,这种方法与途径③相比其优越性在于 。
16.关于下列电化学装置图的说法,正确的是 ( )

A.①装置中阴极处产生的气体能够使湿润淀粉KI试纸变蓝
B.②装置中待镀铁制品应与电源正极相连
C.③装置中电子由b极流向a极
D.④装置中的离子交换膜可以避免生成的Cl2与NaOH溶液反应
|
15.A是一种常见的单质,B、C为中学常见的化合物,A、B、C均含有元素X。它们有如下的转化关系(部分产物及反应条件已略去),下列判断正确的是 ( )
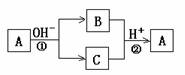 A.X元素可能为Al
A.X元素可能为Al
B.X元素一定为非金属元素
C.反应①和②互为可逆反应
D.反应①和②不一定为氧化还原反应
14.将V1 mL 1.0mol/L HCl溶液和V2 mL未知浓度的NaOH溶液混合均匀后测理并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50mL)。下列叙述正确的是( )
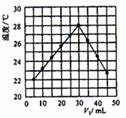 A.做该实验时环境温度为22℃
A.做该实验时环境温度为22℃
B.该实验表明化学能可以转化为热能
C.NaOH溶液的浓度约是1.00mol/L
D.该实验表明有水生成的反应都是放热反应
13.下列有关实验的操作过程,正确的是 ( )
A.钠与水的反应:用镊子从试剂瓶中取出金属钠,用小刀切下绿豆粒大小的一粒钠。小心放入装满水的烧杯中。
B.配制100mL的质量分数10%的H2O2溶液:取一支规格为100mL的量筒,先取质量分数为30%的双氧水溶液33.3mL,然后再加水至100mL刻度线
C.检验某浅绿色溶液中含有Fe2+离子:取该溶液少许,向其中加入KSCN溶液,不变红色;再向其中滴加氯水,溶液变为红色。
D.取出分液漏斗中所需的上层液体:当下层液体从分液漏斗下端管口流出后,及时关闭活塞,然后更换一个接收容器,打开活塞将分液漏斗中的液体放出。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com