
33.(11分)有X、Y、Z三种短周期元素,X的气态氢化物化学式为H2X,此氢化物的相对分子质量与X最高价氧化物的相对分子质量之比为17:40,X原子核内质子数与中子数相等,Y与X可以形成离子化合物Y2X,Y的阳离子电子层结构与Ne相同,Z与X同周期,其气态单质是双原子分子,两原子共有1对电子。试回答:
(1)写出各元素符号:X 、Y 、Z 。
(2)X离子的结构示意图为 。X与Y形成的离子化合物的电子式 ,Z和氢形成的化合物的电子式为 。
(3)Y单质在空气中燃烧的化学方程式为 。
32.(8分)电解原理在化学工业中有广泛应用。下图表示一个电解池,装有电解液a,a是饱和NaCl溶液,X、Y都是惰性电极,通过导线与直流电源相连。实验开始时,同时在两极各滴入几滴酚酞试液,则
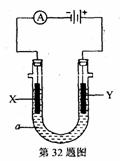
(1)电解过程中反应的总化学方程式为 ;
X极附近观察到的现象是 。
(2)Y电极上的电极反应式为 ;
检验该电极反应产物的方法是 。
31.(5分)火箭推进器盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水。当它们混合反应时,即产生大量氮气和水蒸气,并放出大量的热。已知16g液态肼与足量的液态双氧水反应,生成氮气和水蒸气,放出320.8KJ的热量。
(1)反应的热化学方程式为 。
(2)此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有一个很大的优点是 。
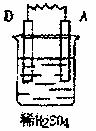
30.(9分)实验室用燃烧法测定某种氨基酸(CXHyOZNP)的分子组成。取wg该种氨基酸放在纯氧中充分燃烧,生成CO2、H2O和N2。现用下图所示装置进行实验(铁架台、铁夹、酒精灯等未画出),请回答有关问题:
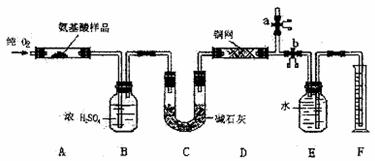
(1)实验开始时,首先打开止水夹a,关闭止水夹b,通一段时间的纯氧,这样做的目的是 ;之后则需关闭止水夹a,并打开止水夹b。
(2)以上装置中需要加热的有(填装置代号) 。
(3)装置D的作用是 。
(4)如果装置中B、C的连接顺序对换,该实验的目的能否达到?简述理由
。
(5)若实验中测得3.3g该种氨基酸充分燃烧,生成N2的体积为224mL(已换算成标准状况);生成二氧化碳气体的质量为7.92g;生成水的质量为1.98g。又已知该氨基酸的摩尔质量为165g/mol。通过计算确定此氨基酸的分子式为 。
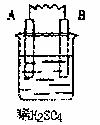
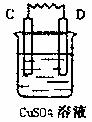
29.(5分)由A、B、C、D四种金属按下表中装置进行实验,已知用C与B相连作电极放入硫酸铜溶液中B溶解。根据实验现象填表:V
|
装 置 |
 |
 |
 |
|
现象 |
金属A溶解 |
C的质量增加 |
A上有气体产生 |
|
正极反应式 |
|
|
|
|
四种金属活动性由强到弱的顺序 |
28.已知1g氢气完全燃烧生成水蒸气时放出热量121kJ。且氧气中1molO=O键完全断裂时吸收热量496kJ,水蒸气中1molH-O键形成时放出热量463kJ,则氢气中1molH-H键断裂时吸收热量为 ( )
A.920kJ B.557kJ C.436kJ D.188kJ
|
27.据报道,最近摩托罗拉公司研制了一种由甲醇和氧气以及强碱作电解质溶液的新型手机电池,电量可达现用镍氢电池或锂电池的10倍。有关次电池的叙述错误的是 ( )
A.正极电极反应式:O2+2H2O+4e-=4OH-
B.负极电极反应式:CH3OH+8OH--6e-=CO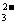 +6H2O
+6H2O
C.电池在使用过程中,电解质溶解的pH增大
D.当外电路通过1.2mol电子时,理论上消耗甲醇6.4g
26.下图是电解CuCl2溶液的装置,其中c、d为石墨电级则下列有关的判断正确的是 ( )
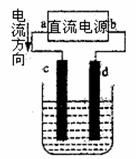
A.a为正极、b为负极
B.a为阳极、b为阴极
C.电解过程中,d电极质量不变
D.电解过程中,氯离子浓度不变
25.有一种银锌电池,其电极分别是Ag2O和Zn,电解质溶液为KOH,电极反应为:
Zn+2OH--2e-=ZnO+H2O;Ag2O+H2O+2e-=2Ag+2OH-,总反应式:Ag2O+Zn=ZnO+2Ag
根据上述反应式,判断下列叙述中正确的是 ( )
A.在使用过程中,电池负极区溶液的pH减小
B.在使用过程中,电子由Ag2O极流向Zn极
C.Zn是正极,Ag2O是负极
D.Zn极发生还原反应,而Ag2O极发生氧化反应
24. 有2L密闭容器中,发生3A(g)+B(g) 2C(g)的反应,若最初加入A和B都是4mol,A的平均反应速率为0.12mol·L-1·s-1,则10s后容器中B的物质的量是
有2L密闭容器中,发生3A(g)+B(g) 2C(g)的反应,若最初加入A和B都是4mol,A的平均反应速率为0.12mol·L-1·s-1,则10s后容器中B的物质的量是
( )
A.1.6mol B.2.8mol C.3.2mol D.3.6mol
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com