
2.实验室中的药品常按物质的性质、类别等有规律地摆放。现有部分药品按某种规律摆放在实验桌上,如下图。做“硫酸的性质”的实验时,某同学取用 溶液后,应把它放回的位置是
溶液后,应把它放回的位置是
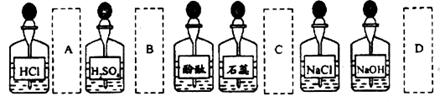
1.下列表述正确的是
①现代研制的油漆中一般不使用甲醛、酚类等化合物,因为这些化合物对人体有毒
②我国从2000年起逐渐用二氧化氯取代氯气对饮用水进行消毒,因为二氧化氯杀菌、消毒能力强,持效长
③我国禁止汽车使用含铅汽油,其主要原因铅资源短缺
④明矾能使水中的悬浮物凝聚,可作为净水剂
⑤赤潮、白色污染、绿色食品都与相关物质颜色有关
⑥给机动车安装尾气净化器,可减少光化学烟雾的发生
⑦开发使用新型清洁能源,减少化石燃料的燃烧,可从根本上防止酸雨的产生
A.①③④⑤⑥ B.①②④⑥⑦ C.②③④⑤⑥ D.全部
27.(10分)接触法制硫酸排放的尾气中,含少量的二氧化硫。
(1)为了测定尾气中二氧化硫的体积分数,取10.0 L尾气(标准状况)缓慢通过足量的溴水,然后在此溶液中加入过量的BaCl2溶液,产生白色沉淀,将沉淀过滤、洗涤、干燥后称重为0.233 g。则尾气中二氧化硫的体积分数为 。
(2)某研究小组用氨水吸收尾气中的SO2,再向吸收液中加入硫酸,制取高浓度的SO2气及(NH4)2SO4和NH4HSO4固体。为测定所得固体样品中(NH4)2SO4和NH4HSO4的含量,现称取该样品四份,分别和80.0 mL相同浓度的NaOH溶液混合,并加热到90℃左右,充分反应,使氨气全部逸出[设此时(NH4)2SO4和NH4HSO4均没发生自身的分解]。测得有关实验数据如下表(气体体积均已折算为标准状况):
|
实验序号 |
样品质量/g |
氢氧化钠溶液的体积/mL |
氨气的体积/mL |
|
Ⅰ |
14.8 |
80.0 |
3.36 |
|
Ⅱ |
29.6 |
80.0 |
4.48 |
|
Ⅲ |
44.4 |
80.0 |
2.24 |
|
Ⅳ |
74.0 |
80.0 |
0.00 |
|
①当用7.4g该样品和80.0 mL相同浓度的氢氧化钠溶液混合而进行同样的实验时,在标准状况下生成氨气的体积为 。
②试计算该样品中(NH4)2SO4和NH4HSO4的物质的量之比。
③欲计算实验所用的氢氧化钠溶液的物质的量浓度,则应选择序号 的实验数据,由此求得氢氧化钠溶液的物质的量浓度为 。
26.(6分)过氧化钙是一种安全无毒的氧化物,通常含有部分CaO,且带有数量不等的结晶水。为分析某过氧化钙样品的组成,进行了如下实验。
①称取0.271g样品,灼热使之完全分解,生成CaO、O2和H2O,得到的O2在标准状况下的体积为33.6mL。
②另取0.271g样品,溶于稀盐酸,加热煮沸使生成的H2O2完全分解。然后将溶液中的Ca2+完全转化成CaC2O4沉淀,经过滤洗涤后,将沉淀溶于热的稀硫酸,用0.0700mol/L KMnO4溶液滴定,共用去20.0mL KMnO4溶液。化学方程式如下:
5CaC2O4+2KMnO4+8H2SO4=K2SO4+2MnSO4+5CaSO4+10CO2+8H2O
(1) 计算0.271g样品中的CaO2的物质的量。
(2)计算样品中的CaO2·xH2O的x值。
25.(10分)下列是中学化学中常见物质间的反应转化关系图,其中部分产物已略去。常温下,G为固体单质,B、I为液体,其余都为气体。A为化合物,I的浓溶液与G在加热条件下生成F、B和C。H可用作工业上冶炼金属的还原剂。


请按要求填空:
(1)写出下列物质的化学式:A: ; B: ; C: 。
(2)写出A→D的化学方程式 。
(3)写出G和I的浓溶液反应的化学方程式 。
24.(12分)某化学兴趣小组,专门研究了氧族元素及其某些化合物的部分性质。查得的资料如下:
①常温下硒(Se)和碲(Te)为固体,H2Se和H2Te为气体;
②Te和H2不能直接化合生成H2Te;
③氧气、硫、硒、碲与1 molH2反应的焓变如下表所示。
|
物质 |
O2 |
S |
Se |
Te |
|
△H(kJ·mol-1) |
-242 |
-20 |
81 |
|
请回答下列问题:
(1)写出氧族元素中含有18个电子的两种氢化物的化学式 、 。
(2)写出硒化氢发生分解反应的热化学方程式:
。
(3)已知298K时,H2Te分解反应的△S >0,△H =-154kJ/mol。试解释Te和H2不能直接化合的原因 。
(4)H2S的水溶液显弱酸性,写出其电离方程式
;硫氢化钠溶液显碱性原因是 。
(5)一定温度下,在容积均为1L(容器容积不可变)的甲、乙两个容器中,分别充入2 mol SO2、1 mol O2和4 mol SO2、2 mol O2,在相同条件下使其反应。最终达到平衡后,甲、乙两容器中SO2转化率分别为50%和(乙),则该温度下,反应的平衡常数K= (填写具体数据),此时(乙) 50%(填“大于”、“小于”或“等于”)。
23.(8分)根据要求完成反应方程式:
(1)氯气通入石灰乳中,写出化学方程式__________________________。
(2)向纯碱溶液中通入过量的SO2气体,化学方程式为________________。
(3)向硫酸铝溶液中加入过量氢氧化钠溶液,离子方程式是________________。
(4)向硫酸亚铁酸性溶液中加入次氯酸钠溶液,则离子方程式为____________。
22.(14分)研究某一化学反应的实验装置如下图所示:

A-F属于下列物质中的六种物质:
浓硫酸、浓盐酸、浓氨水、稀硫酸、稀盐酸、水;
锌粒、铜片、食盐、高锰酸钾、氯化钙、氧化钙、四氧化三铁、氧化铁、氧化铜;
氢气、二氧化碳、二氧化氮、一氧化碳、氯气、氯化氢、氨气、氮气、氧气。
实验现象:①物质D由黑色变为红色
②无水硫酸铜粉末放入无色透明的E中得到蓝色溶液
③点燃的镁条伸入无色无味的F中.镁条表面生成一种灰黄色固体物质。将该灰黄色物质放入水中,有气体放出,该气体具有刺激性气味。并能使润湿的红色石蕊试纸变蓝。
通过分析回答:
(1)写出A-F的物质名称:
A ,B ,C ,D ,E ,F 。
(2)写出有关的化学方程式:
C与D ;
E与无水硫酸铜 ;
F与Mg ;
F与Mg的反应产物与水 。
21.(10分)为测定硫酸铵和氯化铵固体混合物中氯化铵的质量分数,甲、乙两位同学按下列所示的实验步骤进行实验:称量样品、溶解、加过量试剂A、过滤出沉淀B、洗涤沉淀、烘干称量、处理实验数据,得出结果。
(1)实验时,甲同学选用硝酸银溶液作试剂A,乙同学选用氯化钡溶液作试剂A。其中
___ (填“甲”或“乙”)同学选择试剂A不合理,其理由是 。
(2)以下都是试剂A选择正确时进行的实验:
①为进行称量、溶解、反应、过滤、洗涤沉淀的各项操作,准备了以下仪器:托盘天平与砝码、过滤器、铁架台及附件、胶头滴管、量筒,其中还缺少的必备仪器是
②若过滤所得沉淀未经洗涤即烘干称量,测出的氯化铵的质量分数 (填“偏高”、“偏低”或“不变”)
③检验加入的试剂A是否过量的方法是 。
20.向Fe2(SO4)3 、CuCl2的混合溶液中投入足量的铁粉充分反应后,得固体经过滤、干燥、称重,知所得固体的质量与加入的铁粉质量相等,则原混合溶液中c(SO42-)与c(Cl-)之比是: ( )
A.3︰2 B.1︰7 C.2︰7 D.3︰14
|
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com