
3.可逆反应A(g)十3B(g)  2C(g)+2D(g),在四种不同的情况下的反应速率分别为:①v(A)= 0.15
mol/(L·s),②v(B)=0.6 mol/(L·s),③v
(c)=0.3 mol/(L·s),④v(D)=0.2 mol/(L·s)。该反应进行最快的是
2C(g)+2D(g),在四种不同的情况下的反应速率分别为:①v(A)= 0.15
mol/(L·s),②v(B)=0.6 mol/(L·s),③v
(c)=0.3 mol/(L·s),④v(D)=0.2 mol/(L·s)。该反应进行最快的是
A.① B.② C.③ D.④
2.下列反应中生成物总能量高于反应物总能量的是
A.碳酸钙受热分解 B.乙醇燃烧 C.铝粉与氧化铁粉末反应 D.氧化钙溶于水
1.下列溶液肯定呈酸性的是
A.pH=6的溶液 B.c(OH一)<c(H+)的溶液
C.c(H+)=10-6mol/L的溶液 D.含有H+离子的溶液
27.(10分)合成氨工业生产中所用的催化剂的主要成分是FeO、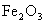
(1)某FeO、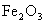 混合物中,铁、氧的物质的量之比为4:5,求Fe
混合物中,铁、氧的物质的量之比为4:5,求Fe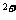 与Fe
与Fe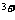 物质的量之比。
物质的量之比。
(2)当催化剂中Fe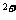 与Fe
与Fe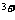 的物质的量之比为l:2时,其催化活性最高,此时铁的氧化物混合物中铁的质量分数是多少?(用小数表示,保留2位小数)。
的物质的量之比为l:2时,其催化活性最高,此时铁的氧化物混合物中铁的质量分数是多少?(用小数表示,保留2位小数)。
(3)以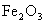 为原料制备(2)中所述的催化剂,可向其中加入适量炭粉,发生如下反应:
为原料制备(2)中所述的催化剂,可向其中加入适量炭粉,发生如下反应: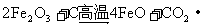 ,为制得这种活性最高的催化剂,应向480g
,为制得这种活性最高的催化剂,应向480g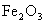 粉末中加入多少克炭粉?
粉末中加入多少克炭粉?
26.(10分)一定量的氢气在氯气中燃烧,所得混合物用100mL4.00mol/L的NaOH溶液(密度为l.12g/mL)恰好完全吸收,测得溶液中含有NaClO的物质的量为0.0500mol。
(1)原NaOH溶液的质量分数是多少?(保留3位有效数字)
(2)所得溶液中C1 的物质的量是多少?
的物质的量是多少?
25.(10分)有一块表面被氧化成氧化钠的金属钠,质量是10.8g,将它投入到l00g水中完全反应后,收集到0.2gH ,试计算:
,试计算:
(1)氧化钠的质量是 克;
(2)被氧化前金属钠的质量是 克;
(3)反应后所得溶液溶质的质量分数为 。(保留3位有效数字)
24.(10分)二氧化锰和浓盐酸反应制备氯气的化学方程式为: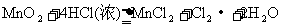 ,在该反应中,氧化剂是
,氧化产物是
,被氧化与未被氧化的HCl的质量之比为 ,若生成的氯气在标准状况下为22.4L,则有
mol电子发生转移,被氧化的HCl的物质的量为
。
,在该反应中,氧化剂是
,氧化产物是
,被氧化与未被氧化的HCl的质量之比为 ,若生成的氯气在标准状况下为22.4L,则有
mol电子发生转移,被氧化的HCl的物质的量为
。
22.(5分)某一反应体系有反应物和生成物共五种物质:
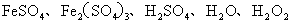
已知该反应中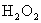 只发生如下过程:
只发生如下过程:
请将5种物质分别填入下面对应的横线上,组成一个未配平的化学方程式。
+
+
 +
+
反应物中发生氧化反应的物质 ,被还原的元素是 。
[选做部分](注意:23题分A、B两题,考生可任选一题。若两题均做,一律按A题计分。)
23(A).(10分)A、B、C、D四种可溶性盐,它们的阳离子分别可能是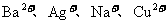 中的某一种,阴离子分别可能是
中的某一种,阴离子分别可能是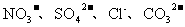 的某一种。
的某一种。
(1)若把四种盐分别溶解于盛有蒸馏水的四只试管中,只有C盐的溶液呈蓝色。
(2)若向(1)的四只试管中分别加盐酸,B溶液有沉淀产生,D盐溶液有无色无味气体逸出。根据(1)(2)实验事实可推断它们的化学式为:
A ;B ;C ;D 。
写出B、D与盐酸反应的离子方程式:
; 。
23(B).(10分)某研究小组在探究硫酸氢钠溶液(0.1mol/L)和氢氧化钡溶液(0.1mol/L)反应 的过程中,测得:
①当溶液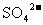 和
和 恰好沉淀时,两种溶液反应的体积比为1:1,写出该过程的离子方程式:
;此时反应后溶液的溶质为
。
恰好沉淀时,两种溶液反应的体积比为1:1,写出该过程的离子方程式:
;此时反应后溶液的溶质为
。
②当反应后的溶液呈中性时,两种溶液的体积比为2:1,写出该过程的离子方程式:
;此时反应后溶液的溶质为 。
21.(8分)用固体烧碱配制500mL0.1mol·L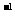 的NaOH溶液,请回答以下问题:
的NaOH溶液,请回答以下问题:
(1)需称量 g烧碱固体,它应盛在 中进行称量。
(2)配制过程中,不需要使用的仪器是(写代号) 。
A、托盘天平 B、药匙 C、烧杯 D、胶头滴管 E、玻璃棒
F、1000mL容量瓶 G、500mL容量瓶
(3)若配制0.1mol·L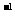 的NaOH溶液的其它操作均正确,但出现下列错误操作,其中将使配制的NaOH溶液浓度偏高的是
(填序号)。
的NaOH溶液的其它操作均正确,但出现下列错误操作,其中将使配制的NaOH溶液浓度偏高的是
(填序号)。
A.将NaOH溶液转移至容量瓶后,未洗涤烧杯和玻璃棒
B.将烧杯内的NaOH溶液向容量瓶中转移时,因操作不当使部分溅出瓶外
C.定容摇匀后,发现液面低于刻度线,又加水至液面与刻度线相切
D.定容时俯视容量瓶的刻度线
20.(6分)请写出下列反应的离子方程式:
(1)氧气与氢氧化钠溶液反应 ;
(2)过氧化钠与水反应 ;
(3)FeCl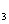 溶液中加入铁粉
。
溶液中加入铁粉
。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com