
23.(10分)(1)在纯碱溶液中滴入酚酞,溶液变红。若在该溶液中再滴入过量的氯化钡溶液, 所观察到的现象是____________________________:其原因是(以离子方程式和简要文字说明):__________________________________________________________________________
______________________________________________________________________________。
(2)氯化铁水溶液呈_______________性,原因是(用离子方程式表示) ___________________把FeCl3溶液蒸干,灼烧,最后得到的主要同体产物是__________________________。
(3)明矾溶液与Na2S溶液混合,放出臭鸡蛋气味的气体并生成白色沉淀(用离子方程式表示) ______________________________________________________________________________。
22.(8分)如图A为直流电源,B为浸透饱和氯化钠溶液和酚酞试液的滤纸,C中盛有100mL、0.1mol/L的硝酸银溶液,c、d、e、f均为惰性电极。接通电路后,发现B上的c点显红色。请填空:
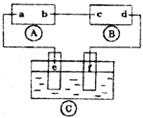
(1)电源A上的a为__________极;
(2)滤纸B上发生的总化学反应方程式为________________________________________;
(3)电极e上发生的反应式为________________________________________。
(4)C中若生成标准状况下5.6mLO2,则溶液的pH__________。(假定溶液体积仍为l00mL)
21.(10分)在某一容积为5 L的密闭容器内,加入0.2 mol的CO和0.2mol的H2O,在催化剂存在和800℃的条件下加热,发生如下反应:
CO(g)+H2O(g)  CO2
(g)+H2 (g);△H>0 反应中CO2的浓度随时间变化情况如下图,
CO2
(g)+H2 (g);△H>0 反应中CO2的浓度随时间变化情况如下图,
根据图上数据同答:
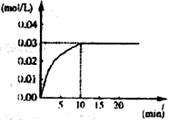
(1)反应开始至达到平衡时,CO的化学反应速率为v(CO)=_______mo/(L·min);反应达平衡时,c(H2)=___________mol/L,该温度下的平衡常数K=____________。
(2)如要一开始加入0.lmol的CO、0.1mol的H2O、0.1 mol的CO2和0.1mol的H2,在相同的条件下,平衡向_______方向移动(填正反应或逆反应或不移动),反应达平衡时,c(H2O)=________mol/L。
20.[NH4+]相同的下列溶液①NH4Cl ②(NH4)2SO4 ③NH4HSO4 ④NH4HCO3,其物质的量浓度由大到小的顺序是
A、②③①④ B、④①③② C、①④③② D、②④①③
第Ⅱ卷(非选择题,共50分)
19.用氢氧燃料电池(电解质溶液为氢氧化钾水溶液)电解饱和硫酸钠溶液一段时间,假设电解时温度不变且用惰性电极,下列说法正确的是
A.当电池负极消耗mg气体时,电解池阳极同时有mg气体生成
B.电池的负极反应式为:O2+2H2O+4e-=4OH-
C.电解后Na2SO4溶液浓度不变,且溶液中有晶体析出
D.电池中KOH溶液浓度不变;电解池中溶液PH变大
18.室温下pH相同、体积相同的醋酸和盐酸两种溶液分别采取下列措旗,有关叙述正确的是
A.加水稀释2倍后,两溶液的PH均减小
B.使温度都升高20℃后,两溶液的pH均不变
C.加适量的醋酸钠晶体后,两溶液的pH均增大
D.加足量的锌充分反应后,醋酸产生的氢气比盐酸少
17.已知在四个容积相同的密闭器中,分别充入下列四组混合气体,分别发生如下可逆反应:
CO2(g)+H2(g)  CO(g)+H2O(g),并使它们在相同温度下达到平衡,则平衡混合气中CO的物质的量浓度从大到小的顺序是
CO(g)+H2O(g),并使它们在相同温度下达到平衡,则平衡混合气中CO的物质的量浓度从大到小的顺序是
①1molCO2和1molH2 ②1molCO2和2molH2
③1molCO2、2mol H2和2molCO ④1molCO2、1mol H2和1molHO2
A.③①②④ B.④①③② C.③②④① D.③②①④
16.2005年10月12日我国成功发射了“神州六号”。发射“神六”时用肼(N2H4)作为火箭发动机的燃料,NO2为氧化剂。反应生成N2和水蒸气。已知:N2(g)+2O2(g)==2NO2(g):△H=+67.7KJ/mol N2H4(g)+O2(g)==N2(g)+2H2O(g);△H=-534KJ/mol 下列关于肼和NO2反应的热化学方程式中,正确的是
A.2N2H4(g)+2NO2(g)===3N2(g)+4H2O(g);△H=-1135.7KJ/mol
B.2N2H4(g)+2NO2(g)===3N2(g)+4H2O(g);△H=-1000.3KJ/mol
C.N2H4(g)+NO2(g)===3/2N2(g)+2H2O(g);△H=-1135.7KJ/mol
D.2N2H4(g)+2NO2(g)===3N2(g)+4H2O(g);△H=-1135.7KJ/mol
15.向0.1mol/L醋酸溶液中加水稀释或加少量醋酸钠晶体时,都会引起的变化是
A.溶液的pH增大 B.醋酸的电离度增大
C.溶液的导电能力减弱 D.溶液中氢氧根离子浓度减少
14.下列选项中所列的两个量,前者大于后者的是
A.碳酸钠溶液在20℃和80℃时的碱性
B.同温下,0.3mol/L的醋酸溶液和0.1mol/L的醋酸溶液中醋酸的电离程度
C.同温同浓度的条件下,NaHSO4和NaHCO3溶液中水电离出的c(OH-)
D.纯水在20℃和80℃时的pH
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com