
5.氧化还原反应的实质是电子的转移,下列关于氧化还原反应的叙述正确的是 ( )
A.在氧化还原反应中,有一种元素被氧化,肯定有另一种元素被还原
B.11.2L Cl2通入足量的NaOH溶液中,转移的电子数为0.5NA
C.难失电子的原子,得电子的能力一定强
D.元素由化合态变成游离态时,它可能被氧化,也可能被还原
4.设NA为阿伏加德罗常数,下列说法不正确的是 ( )
A.18g水中含有的电子数为10NA
B.46g二氧化氮和46g四氧化二氮含有的原子数均为3NA
C.1L 1mol·L-1的盐酸溶液中,所含氯化氢分子数为NA
D.标准状况下,11.2L臭氧中含1.5NA个氧原子
3.下列叙述正确的是 ( )
A.由同种元素组成的物质肯定属于纯净物
B.一种元素可形成多种离子,但只能是带同种电荷的离子
C.含金属元素的离子不一定都是阳离子
D.具有相同质子数的粒子都属于同种元素
2.2007年10月24日,“嫦娥一号”开始了它的探月历程,它的一项重要任务是探测月球表面土壤里的一种非常有用的资源--可控核聚变的原料3He,3He是一种安全高效而又清洁无污染的物质,据统计,月球上的3He可以满足人类1万年以上的供电需求,月球土壤的3He含量可达500万吨。关于3He的叙述正确的是 ( )
A.3He和4He两种核素互为同素异形体
B.3He和4He两种核素互为同位素
C.核聚变时,原子核发生了变化,发生了化学反应
D.在3He中存在:质子数=中子数=核外电子数
1.2008年夏季奥运会将在我国举行,这次奥运会要突出“绿色奥运、科技奥运、人文奥运”的理念,其中“绿色奥运”是指 ( )
A.把环境保护作为奥运设施规划和建设的首要条件
B.严禁使用兴奋剂,使运动员公平竞争
C.所有奥运用品全是绿色的
D.奥运场馆建设均使用天然材料,不使用合成材料
2.(8分)如图,将4 mol SO2和2 mol O2混合置于体积可变的等压密闭容器中,在一定温度下发生如下反应 2SO2 (g)+O2 2SO3 (g);△H<0,该反应达到平衡状态时,测得气体的总物质的量为4.2 mol。试回答:
2SO3 (g);△H<0,该反应达到平衡状态时,测得气体的总物质的量为4.2 mol。试回答:

(1)在该平衡状态时n(SO3)=________________________;
(2)若起始时加入l.2 mol SO2、0.6 mol O2和x mol SO3,达到平衡状态后,各气体的体积分数与上述平衡状态相同,x的取值为________________________;
(3)若反应开始时的v(逆)>v(正),达到上述平衡状态时,气体的总物质的量仍为4.2mol。则起始时n(SO3)的取值范围是_______________________。
1.(12分)草酸(H2C2O4)是一种易溶于水的二元弱酸,在水中它的存在形态可能有H2C2O4、 HC2O4一、C2O42-,各形态的分布系数(浓度分数)  随溶液pH变化的关系如下图所示:
随溶液pH变化的关系如下图所示:
草酸各种形体的pH分布图
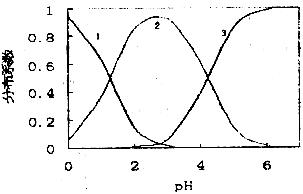
(1)上图中曲线1表示___________的变化:曲线2表示__________的变化;
(2)若已知草酸的电离平衡常数为K l=
l= 、K
、K 2=b,当[H2C2O4]=[HC2O4-]时,溶液的[H+]=_________;当[H2C2O4]=[ C2O42-]时,溶液的[H+]==________ ;
2=b,当[H2C2O4]=[HC2O4-]时,溶液的[H+]=_________;当[H2C2O4]=[ C2O42-]时,溶液的[H+]==________ ;
(3)草酸氢钾溶液呈酸性。在0.1mol·L-l KHC2O4溶液中,下列关系正确的是____________;
A.[K+]+[H+]=[HC2O4-]+[OH一]+[C2O42-] B.[HC2O4-]+[C2O42-]=0.1 mol·L-1
C.[C2O42-]+[H2C2O4] D.[K+]=[H2C2O4]+[HC2O4一]+[ C2O42-]
(4)等浓度的①H2C2O4、②KHC2O4、③NH4HC2O4、④K2C2O4、⑤(NH4)2C2O4溶液中C2O42-浓度从大到小的顺序为____________________________________________;
(5)一定体积的KMnO4溶液恰好能氧化一定质量的KH C2O4·H2C2O4·2H2O。若用0.100mol/L的NaOH溶液中和相同质量的KHC2O4·H2C2O4·2H2O,所需NaOH溶液的体积恰好为KMnO4 溶液的3倍,则KMnO4溶液的浓度为__________________________________。
提示:10[KHC2O4·H2C2O4] +8KMnO4+17H2SO4=8MnSO4 +9K2SO4+40CO2↑+32H2O
26.(6分)将对H2相对密度为3.6的N2和H2组成的混合气体0.5mol,通入一密闭的恒容容器中。一定条件下发生反应,平衡时测得容器内压强比反应前小24%,求:
(1)平衡时混合气体中氨的体积分数;
(2)平衡时N2和H2的转化率。
发展卷(20分)
备注:请在认真完成卷I、卷Ⅱ基础上选做本发展卷。
25.(8分) (1)常温1mL pH=12的NaOH溶液加水稀释至100mL,稀释后的溶液中 =_______;
=_______;
(2)常温pH=13的Ba(OH)2溶液 L与PH=3的HCl 溶液bL混合(混合后溶液体积变化忽略不计)。若所得溶液pH=7, 则
L与PH=3的HCl 溶液bL混合(混合后溶液体积变化忽略不计)。若所得溶液pH=7, 则 :b=____________________________;
:b=____________________________;
(3)某温度时测得0.01mol·L-1的NaOH溶液的pH=11,则该温度下水的KW=__________;在此温度下,将pH= 的NaOH溶液V
的NaOH溶液V L与PH=b的H2SO4溶液VbL混合。若所得混合液的pH=10,且
L与PH=b的H2SO4溶液VbL混合。若所得混合液的pH=10,且 =12,b=2,则V
=12,b=2,则V :Vb=_____________。
:Vb=_____________。
24.(8分)(1)在25℃条件下将pH=11的氨水稀释l00倍后溶液的pH为(填序号)_________。
A.9 B.13 C.11-l3之间 D.9-11之间
(2) 25℃时,向0.1mol/L的氨水中加入少量氯化铵固体,当固体溶解后,测得溶液PH减小,主要原因是(填序号) ________________。
A.氨水与氯化铵发生化学反砬
B.氯化铵溶液水解显酸性,增加了c(H+)
C.氯化铵溶于水,电离出大量铵离子,抑制了氨水的电离,使c (OH-)减小:
(3)室温下,如果将0.1mol NH4Cl 和0.05molNaOH全部溶于水,形成混合溶液(假设无损失),
①_____________和_____________两种粒子的物质的量之和等子0.1mol。
②_____________和_____________两种粒子的物质的最之和比OH一多0.05mol。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com