
29.(16分)U、V、W、X、Y、Z是原子序数依次增大的六种常见元素。Y的单质在W2中燃烧的产物可使品红溶液褪色。Z和W元素形成的化合物Z3W4具有磁性。U的单质在W2中燃烧可生成UW和UW2两种气体。X的单质是一种金属,该金属在UW2中剧烈燃烧生成黑、白两种固体。
请回答下列问题:
(1)V单质分子的结构式为 ; W元素在周期表中的位置是 。
(2)U元素形成的同素异形体的晶体类型可能是(填序号) 。
① 原子晶体 ② 离子晶体 ③ 分子晶体 ④ 金属晶体
(3) U、V、W形成的10电子氢化物中,U、V的氢化物沸点较低的是(写化学式) ;V、W的氢化物分子结合H+能力较强的是(写化学式) ,
用一个离子方程式加以证明
(4)YW2气体通入BaCl2和HNO3的混合溶液中,生成白色沉淀和无色气体VW,有关反应的离子方程式为 。
28.(15分) A、B、C为短周期元素形成的单质,其它物质为常见的化合物,它们之间的转换关系如下(某些产物已省略)。其中甲为淡黄色物质,乙在常温下为液体,戊的式量比丁的式量大16,丙、己是重要的无机化工原料。回答下列问题:
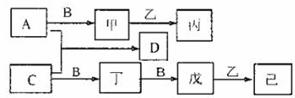
(1)写出甲物质的电子式 ;写出A直接生成丙的离子方程式: 。
(2)若C在常温下为气体,写出戊和乙反应生成己的化学方程式: 。
(3)若C在常温下为固体,写出丙和戊反应生成正盐的化学方程式: ;
工业生产己的过程中吸收戊的试剂是: ;
工业生产己的主要设备的名称为: ;
向足量的D溶液加入0.78g甲充分反应后有C的单质析出,设反应后溶液体积为400mL,则反应后溶液的pH是 。
27.(18分)(1)实验室要配制1mol/L的稀硫酸250mL,回答下列问题:
① 需要98%密度为1.84g/cm3的浓硫酸 mL。
② 配制时,必须使用的仪器除 20 mL量筒, 250 mL容量瓶,玻璃棒外,还需要的仪器有 。
③ 配制时,该实验两次用到玻璃棒,其作用分别是 、 。
④ 配制过程中出现以下情况,对所配溶液浓度有何影响(填“偏高”、“偏低”或
“不影响”)没有洗涤烧杯和玻璃棒 ;容量瓶没有干燥 。
(2)用如下图所示装置(夹持仪器省略,暂不考虑尾气的吸收)进行实验,将液体A逐滴加入到固体B中,回答下列问题:

① 如何检验该装置的气密性 。
② 若A为30%H2O2溶液,B为MnO2,C盛有氢硫酸(H2S)饱和溶液,旋开E后,C中的现象为________________ ;B中发生反应的化学方程式为_____________ 。
③ 若A为浓盐酸,B为KMnO4,C中盛有KI淀粉溶液,旋开E后,C中的现象是___________________ ;
B中发生反应的离子方程式为_________________ 。
④ 图中D装置在实验中的作用是____________________________ 。
26.(11分)(1)氢气是一种高效而无污染的理想能源,近20年来,对以氢气作为未来的动力燃料氢能源的研究获得了迅速发展。
① 为了有效发展氢能源,首先必须制得廉价的氢气,下列可供开发又较经济且资源可
持续利用的制氢气的方法是 。
A. 锌和稀硫酸反应 B.光解海水 C.以石油、天然气为原料
② 已知氢气的燃烧热为285.8kJ·mol-1。写出其完全燃烧的热化学方程式 。
(2)有资料报道:Na2FeO4是一种强氧化剂,可作为一种新型净水剂,因此使用该物质可代替Cl2和Al2(SO4)3作为净水剂。
① 配平工业制备铁酸钠的化学方程式:
□Fe2O3+□NaNO3+□NaOH--□Na2FeO4+□NaNO2+□H2O
② 以上反应中,氧化剂为 (填编号)。
a.Fe2O3 b.NaNO3 c.NaOH d.Na2FeO4 e.NaNO2
③ 当反应物中含有1.4molNa+,且上述反应恰好完全进行时,电子转移总数为 NA
13.在一定温度和压强下,将一支容积为15mL的试管充满NO2后,倒置于一个盛水的水槽中,当试管内液面上升至一定高度不再变化时,在相同的条件下再通入O2,若要使试管内的液面仍处在原高度,则通入的O2体积为 ( )
A.3.75mL B.7.5mL C.8.75mL D.10.5mL
|
12.X+、Y+、M2+、N2- 均为含有一定数目电子的短周期元素的简单离子,离子半径大小关系是:N2->Y+、Y+>X+、Y+>M2+,下列比较正确的是 ( )
A.原子半径:N可能比Y大,也可能比Y小
B.原子序数:N>M>X>Y
C.M2+、N2-核外电子数:可能相等,也可能不等
D.碱性:M(OH)2>YOH
11.下列各组离子在碱性溶液中能大量共存,且溶液无色透明,加酸酸化后溶液变色,但无沉淀也无气体生成的是 ( )
A.Fe2+、I-、ClO-、SO42- B.Br-、K+、SO42-、BrO3-
C.S2-、SO32-、K+、SO42- D.Ca2+、Cl-、HCO3-、Na+
10.K2SO3易被KMnO4等强氧化剂氧化,现将18mL 0.2mol/L的K2SO3溶液与含有
|
A.+6 B.+4 C.+2 D.+7
9.现有Na2CO3、H2SO4、Ba(OH)2 三种物质的量浓度与体积都相等的溶液,若以不同顺序将它们中的两种混合起来,如果出现沉淀则过滤,再将滤液与第三种溶液混合起来,最终所得的溶液 ( )
A.一定呈酸性 B.一定呈碱性
C.可能呈中性 D.一定呈中性
8.若NA表示阿佛加德罗常数,下列说法正确的是 ( )
A.2.24LCO2中含有的原子数为0.3NA
B.0.1L 3mo1·L-1的NH4NO3溶液中含有的NH4+数目为0.3NA
C.1 mol Cl2作为氧化剂得到的电子数为NA
D.14g氮气中含有7NA个电子
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com