
9.反应(1)、(2)分别是从海藻灰和智利硝石中提取碘的主要反应:
2NaI+MnO2+3H2SO4=2NaHSO4+MnSO4+2H2O+I2 (1)
2NaIO3+5NaHSO3=2Na2SO4+3NaHSO4+H2O+I2 (2)
下列说法正确的是
A.两个反应中NaHSO4均为氧化产物
B.I2在反应(1)中是还原产物,在反应(2)中是氧化产物
C.氧化性:MnO2>SO42->IO3->I2
D.反应(1)、(2)中生成等量的I2时转移电子数之比为1:5
8.下列表述中正确的是
A.任何能使熵值增大的过程都能自发进行
B.已知热化学方程式2SO2(g)+O2(g) 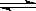 2SO3(g);△H=-QkJ·mol-1(Q>0),
2SO3(g);△H=-QkJ·mol-1(Q>0),
则将2mol SO2(g)和1mol O2(g)置于一密闭容器中充分反应后放出QkJ的热量
C.在AgNO3溶液中加入过量的稀盐酸后,溶液中不存在Ag+
D.1mol NaOH分别和1mol CH3COOH、1molHNO3反应,后者比前者放出的热量多
7.同温同压下,下列各热化学方程式中反应热数值最小的(均为吸热反应)
A.2A(g)+B(g)=2C(l);△H=+Q1kJ·mol-1
B.2A(g)+B(g)=2C(g);△H=+Q2kJ·mol-1
C.2A(l)+B(l)=2C(g);△H=+Q3kJ·mol-1
D.2A(l)+B(l)=2C(l);△H=+Q4kJ·mol-1
6.能正确表示下列反应的离子方程式是
A.足量铁与稀硝酸反应:Fe+4H++NO3-=Fe2++4H2O+NO↑
B.碳酸氢钠溶液与少量石灰水反应:HCO3-+Ca2++OH-=CaCO3↓+H2O
C.在硫酸氢钾溶液中加入氢氧化钡溶液至pH=7
Ba2++OH-+H++SO42-=BaSO4↓+H2O
D.在AlCl3溶液中加入过量氨水:Al3++3NH3·H2O=Al(OH)3↓+3NH4+
5.近年来,科学家研制了一种新型的乙醇电池,它用酸性电解质(H+)作溶剂。电池总反应为:C2H5OH+3O2=2CO2+3H2O,下列说法不正确的是
A.乙醇在电池的负极上参加反应
B.1mol CH3CH2OH被氧化转移6mol电子
C.在外电路中电子由负极沿导线流向正极
D.电池正极的正极反应为4H++O2+4e-=2H2O
4.现有常温时pH=1的某强酸溶液10mL,下列操作能使溶液的pH变成2的是
A.加入10mL 0.01mol·L-1的NaOH溶液
B.加入10mL 的水进行稀释
C.加水稀释成100mL
D.加入10mL 0.01mol·L-1的盐酸溶液
3.已知热化学反应方程式:
Zn(s)+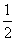 O2(g)=ZnO(s);△H=-351.5kJ·mol-1
O2(g)=ZnO(s);△H=-351.5kJ·mol-1
Hg(l)+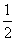 O2(g)=HgO(s);△H=-90.84kJ·mol-1
O2(g)=HgO(s);△H=-90.84kJ·mol-1
则锌汞电池中热化学反应方程式:Zn(s)+HgO(s)=ZnO(s)+Hg(l)的△H为
A.△H=+260.7kJ·mol-1 B.△H=-260.7kJ·mol-1
C.△H=-442.3kJ·mol-1 D.△H=+442.3kJ·mol-1
2.下列操作中,能使电离平衡H2O 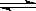 H++OH-,向右移动且溶液呈酸性的是
H++OH-,向右移动且溶液呈酸性的是
A.向水中加入NaHSO4溶液 B.向水中加入Al2(SO4)3固体
C.向水中加入Na2CO3溶液 D.将水加热到100℃,使pH=6
1.下列叙述中,不正确的是
A.某特定反应的平衡常数仅是温度的函数
B.焓变小于0而熵变大于0的反应肯定是自发的
C.平衡常数发生变化,化学平衡必定发生移动,达到新的平衡
D.化学平衡发生移动,平衡常数必发生变化
2007.11
本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分。满分100分,考试时间90分钟。
第Ⅰ卷(选择题 共48分)
相对原子质量:H-1 C-12 O-16 Na-23 Cl-35.5
下列各小题只有一个选项符合题意
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com