
8. 离子在一定条件下可以把Mn2+离子氧化为
离子在一定条件下可以把Mn2+离子氧化为 ,若反应后
,若反应后 离子变为
离子变为 离子,又知反应中氧化剂与还原剂的物质酌量之比为5∶2,则n的值是( )
离子,又知反应中氧化剂与还原剂的物质酌量之比为5∶2,则n的值是( )
A.1 B.2 C.3 D.4
7.关于下列各装置图的叙述中,不正确的是( )

A.装置①中,d为阳极、c为阴极
B.装置②可用于收集H2、NH3、CO2、Cl2、HCl、NO2等气体
C.装置③中X若为四氯化碳,可用于吸收氨气或氯化氢,并防止倒吸
D.装置④可用于干燥、收集氨气,并吸收多余的氨气
6.下列叙述不正确的是( )
A.往下水道中倾倒硫酸铜溶液,会进一步加快铁制管道的腐蚀
B.在空气中,钢铁的表面涂一层油脂或油漆,可以减慢钢铁的腐蚀
C.镁与稀盐酸反应剧烈,加入醋酸钠晶体可以减慢反应速率
D.铜放入稀硫酸中,再加入硝酸钠可以加快铜与稀硫酸的反应速率
5.磁流体是电子材料的新秀,它既具有固体的磁性,又具有液体的流动性。制备时将FeSO4和 的溶液等物质的量混合,滴入稍过量的氢氧化钠溶液,随后加入油酸钠溶液,即可生成黑色的分散质粒子直径在5.5-36nm的磁流体。下列说法正确的是( )
的溶液等物质的量混合,滴入稍过量的氢氧化钠溶液,随后加入油酸钠溶液,即可生成黑色的分散质粒子直径在5.5-36nm的磁流体。下列说法正确的是( )
A.所得的分散系属于溶液
B.所得的分散系中分散质为FeO
C.该分散系进行电泳实验时阳极周围黑色加深
D.油酸钠既有亲水基团又有亲油基团
4.1919年,科学家第一次实现了人类多年的幻想--人工转变元素。这个核反应如下:  ,下列叙述正确的是(
)
,下列叙述正确的是(
)
A. 原子核内有9个质子
原子核内有9个质子
B. 原子核内有1个中子
原子核内有1个中子
C.O2和O3互为同位素
D.通常情况下,He等稀有气体化学性质都很稳定
3.下列说法或表示方法正确的是( )
A.等质量的硫蒸汽和硫固体分别完全燃烧,后者放出的能量多
B.由C(石墨)→(金刚石)△H=+119KJ·mol-1可知,金刚石比石墨稳定
C.在101kPa时,2gH2完全燃烧生成液态水,放出285.8KJ热量,则H2燃烧热的热化学方程式表示为: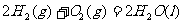

D.在稀溶液中,
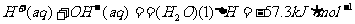 ,若将含0.5mol H2SO4的浓硫酸与含1mol NaOH的溶液混合,放出的热量大于57.3KJ
,若将含0.5mol H2SO4的浓硫酸与含1mol NaOH的溶液混合,放出的热量大于57.3KJ
2.为迎接08北京奥运会的举行,北京大力开展“蓝天计划”行动,实施了一系列举措。其中能够直接减少SO2排放的最有效的措施是( )
A.建立三北防护林,减少沙尘的污染 B.提高汽车尾气的排放标准
C.减少燃煤的使用 D.使用天然气、液化石油气等清洁能源
1.化学与生活是紧密相联的,下列关于生活化学的说法正确的是( )
A.随着人们生活节奏的加快,方便的小包装食品已被广泛接受,为了防止中秋月饼等富脂食品氧化变质,延长食品的保质期,在包装袋中常放人生石灰
B.现在用的清洁燃料主要有两类:一类是压缩天然气,另一类为液化石油气,它们属于碳氢化合物
C.用米汤检验加碘食盐中的碘酸钾(KIO3)
D.保护加酶洗衣粉的洗涤效果,应用沸水溶解洗衣粉
21.(16分)常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
|
实验编号 |
HA物质的量浓度(mol·L-1) |
NaOH物质的量浓度(mol·L-1) |
混合溶液的pH |
|
甲 |
0.2 |
0.2 |
pH=a |
|
乙 |
C |
0.2 |
pH=7 |
|
丙 |
0.2 |
0.1 |
pH>7 |
|
丁 |
0.1 |
0.1 |
pH=9 |
请回答:
(1) 不考虑其它组的实验结果,单从甲组情况分析,如何用a (混合溶液的pH)来说明HA是强酸还是弱酸 。
(2)不考虑其它组的实验结果,单从乙组情况分析,C是否一定等于0.2 (选填“是”或“否”)。混合液中离子浓度c(A-)与 c(Na+)的大小关系是 。
(3)从丙组实验结果分析,HA是 酸(选填“强”或“弱”)。该混合溶液中离子浓度由大到小的顺序是 。
(4)丁组实验所得混合溶液中由水电离出的c(OH-)= mol·L-1。
写出该混合溶液中下列算式的精确结果(不能做近似计算)。
c(Na+)-c(A-)= mol·L-1
c(OH-)-c(HA)= mol·L-1
20.(12分)在一个固定容积的密闭容器中,进行如下化学反应:CO(g)+H2O(g)  CO2(g)+H2(g);△H=QkJ·mol-1,其化学平衡常数K和温度t的关系如下
CO2(g)+H2(g);△H=QkJ·mol-1,其化学平衡常数K和温度t的关系如下
|
t/℃ |
700 |
800 |
850 |
1000 |
1200 |
|
K |
0.6 |
0.9 |
1.0 |
1.7 |
2.25 |
请回答:
(1)上述反应中Q 0(选填“>”或“<”)
(2)能判断该反应已达到化学平衡状态的依据是 。
a.容器中压强不变 b. △H不变
c. v正(H2)=v逆(CO) d. CO的质量分数不变
(3)温度为850℃时,可逆反应:CO(g)+H2O(g)
 CO2(g)+H2(g)在固定容积的密闭容器中进行,容器内各物质的浓度变化如下表:
CO2(g)+H2(g)在固定容积的密闭容器中进行,容器内各物质的浓度变化如下表:
850℃时各物质的浓度(mol·L-1) 变化
|
时间(min) |
CO |
H2O |
CO2 |
H2 |
|
0 |
0.200 |
0.300 |
0 |
0 |
|
2 |
0.138 |
0.238 |
0.062 |
0.062 |
|
3 |
c1 |
c2 |
c3 |
c4 |
|
4 |
c1 |
c2 |
c3 |
c4 |
|
5 |
0.116 |
0.216 |
0.084 |
|
|
6 |
0.096 |
0.266 |
0.104 |
|
①计算:0-4min时v(CO)=________mol/(L·min),H2O(g)的转化率= 。
②反应在4min~5min间,平衡向逆反应方向移动,可能的原因是________(单选),表中5min~6min之间数值发生变化,可能的原因是___________(单选)。
a.增加水蒸气 b.降低温度 c.使用催化剂 d.增加氢气浓度
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com