
19.(13分)海带中含有丰富的碘。为了从海带中提取碘,某学习小组设计并进行了以下实验:
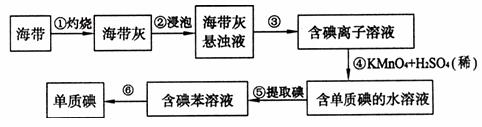
请填写下列空白:
(1)步骤①灼烧海带时,除需要三脚架和泥三角外,还需要用到的实验仪器是
(从下列仪器中选出所需的仪器,用标号字母填写在空白处)。
A.烧杯 B.坩埚 C.表面皿 D.酒精灯
E.干燥器
(2)步骤③的实验操作名称是 ;步骤⑥的目的是从含碘苯溶液中分离出单质碘和回收苯,该步骤的实验操作名称是 。
(3)步骤④反应的离子方程式是 。
(4)步骤⑤中,某学生选择用苯来提取碘的理由是
。
(5)请设计一种检验提取单质碘后的水溶液中是否还残留单质碘的简单方法:
。
18.(3分)下列关于化学实验的叙述中,正确的是 (填序号)。
A.滴定用的锥形瓶和滴定管都要用所盛溶液润洗
B.测量溶液的pH时,应先将pH试纸温润
C.实验室制取乙酸乙酯时,导气管出口端不能插入到饱和Na2CO3溶液的液面以下
D.用溴水除去乙烯中混有二氧化硫气体
E.用碱石灰吸收氨气中的水蒸气
F.分馏石油时,温度计的下端要置于分馏烧瓶的支管口附近
17.将某些化学知识用图像表示,可以收到直观、简明的效果。下列图像所表示的化学知识中,不正确的是 ( )
A.分散系的分类 B.醋酸稀释
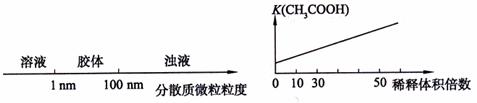
C.向Na2CO3溶液中逐滴滴入盐酸 D.向AlCl3溶液中滴加过量的NaOH溶液

|
[必做部分]
16.一定温度下,在溶积为2L的密闭容器中加入4molA和6molB,发生如下反应:
 2A(g)+3B(g) 4C(g)+D(g),反应10min后达到平衡,此时D的浓度是0.5mol·L-1。
2A(g)+3B(g) 4C(g)+D(g),反应10min后达到平衡,此时D的浓度是0.5mol·L-1。
下列说法中,正确的是 ( )
A.反应达到平衡时[B]= 1.5mol·L-1
B.前10min内反应的平均反应速率v©=0.1mol·L-1·min-1
C.恒温下,将容器容积变为原来的1/2,则平衡向左移动
D.10min后向容器中加A,再次达到平衡时,A的转化率有所增大
15.双球洗气管是一种多用途仪器,常用于除杂质、气体干燥、吸收气体等实验操作。下图是以双球洗气管作为尾气处理装置,用吸收剂X吸收气体Y,其中不符合科学事实的组合是 ( )
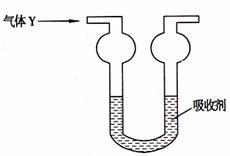
|
|
A |
B |
C |
D |
|
气体A |
Cl2 |
HCl |
NH3 |
SO2 |
|
吸收剂 |
NaOH溶液 |
水 |
稀硫酸 |
浓硫酸 |
14.当降低反应体系的温度时,反应(1)平衡向右移动,反应(2)平衡向左移动。
 C2H2(g)+H2(g) C2H4(g) △Ha (1)
C2H2(g)+H2(g) C2H4(g) △Ha (1)
 CH4(g) H2(g)+
CH4(g) H2(g)+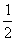 C2H4(g) △Hb (2)
C2H4(g) △Hb (2)
据此判断下列大小关系的表述正确的是 ( )
A.△Ha>△Hb B.△Ha<△Hb C.△Ha=△Hb D.△Ha≥△Hb
13.下列离子方程式书写中,正确的是 ( )
A.氯化铝溶液中加入过量氨水: Al3++4NH3·H2O====[Al(OH)4]-+4NH4+
B.澄清石灰水中滴入少量小苏打溶液:Ca2++2OH-+2HCO3-====CaCO3↓+CO32-+2H2O
C.碳酸钙溶于醋酸: CaCO3+2H+====Ca2++CO2↑+H2O
D.氯化亚铁溶液中通入氯气:2Fe2++Cl2=2Fe3++2Cl-
12.对下列实验现象的解释中合理的是 ( )
|
|
现象 |
解释 |
|
A |
KI淀粉溶液中通入Cl2,溶液变蓝 |
Cl2能与淀粉直接发生显色反应 |
|
B |
浓硝酸在光照条件下变黄 |
浓硝酸见光分解生民有色物质溶于其中 |
|
C |
SO2通入硝酸钡溶液中出现白色沉淀 |
BaSO3不溶于强酸 |
|
D |
铜片放入冷的浓硫酸中,无明显变化 |
铜在冷的浓硫酸中钝化 |
11.下列叙述中,正确的是 ( )
A.可以根据Ksp的大小比较两种电解质的相对强弱
B.常温下,同物质的量浓度的Na2S与NaHS溶液相比,NaHS溶液的pH大
C.等物质的量浓度的NH4Cl溶液和CH3COONH4溶液,后者的c(NH4+)大
D.增大弱电解质溶液的浓度,溶质的电离程度会变小
9.分类方法在化学学科的发展中起到了非常重要的作用。下列分类标准中,不合理的是( )
A.根据物质的组成成分将物质分为纯净物和混合物
B.根据反就中是否有电子转移将化学反应分为氧化还原反应和非氧化还原反应
C.根据物质的导电性将物质分为电解质和非电解质
D.根据反应听热效应将化学反应分为放热反庆和吸热反应
|
A.通C2H6的一极为正极
B.在电解质溶液中,负极处CO32-离子的浓度较大
C.放电一段时间后,KOH的物质的量浓度将下降
D.参加反应的氧气和乙烷的物质的一之比为7:2
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com