
19.(8分)已知氧化性:KMnO4>HNO3;Bi位于周期表中ⅤA族,+3价较稳定,NaBiO3溶液为无色。取一定量的酸性Mn(NO3)2溶液依次进行下列实验,现象记录如下。
①滴加适量的NaBiO3溶液,溶液变为紫红色。
②继续滴加适量H2O2,紫红色褪去,并有气泡产生。
③再加适量的PbO2固体,固体溶解,溶液又变为紫红色。
④最后通入足量的SO2气体,请回答下列问题:
(1)KMnO4.H2O2.PbO2氧化性由强到弱的顺序为 ;
(2)实验④中的现象为 ;
(3)实验②③反应的离子方程式分别是: .
。
20.(5分)甲.乙.丙.丁和戊五种溶液,分别由NH4+.K+.Ag+.Ba2+和Cl-.Br-.NO3-.SO42-.CO32-中的一种组成(离子不重复出现)。其中甲.丙.戊三种溶液呈酸性,乙溶液呈碱性,甲和乙反应可生成白色沉淀和气体,丁可分别与甲.乙.丙反应生成白色沉淀。根据上述事实推断上述溶液中溶质的化学式。
甲 乙 丙
丁 戊
 18.(9分)A.B.C.D.E.F六种物质的相互转化关系如下图所示(反应条件均未列出)。
18.(9分)A.B.C.D.E.F六种物质的相互转化关系如下图所示(反应条件均未列出)。
(1)若A.D.F都是非金属单质,且A.D所含元素同主族,A.F所含元素同周期,则物质B的名称是 。E的电子式是 。
(2)若A是常见金属单质,与B的水溶液反应生成C和D。D.F是气体单质。则A所对应的元素在周期表中的位置是 ,反应②(在水溶液中进行)的离子方程式是 。
(3)若A.D为短周期元素所组成的单质,一种为金属,另一种为非金属,且③.④两个反应都有红棕色气体生成,则反应①.④的化学方程式分别为
①
④
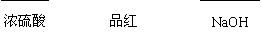
通气一段时间后,甲同学实验过程中品红溶液几乎不褪色,而乙同学的实验现象是品红溶液的颜色随时间推移变得越来越浅。试根据该实验装置和两名同学的实验结果回答下列问题。
①指出在气体进入品红溶液之前,先将SO2和Cl2通入浓硫酸的目的:
②试分析甲同学实验过程中,品红溶液不褪色的原因
(结合离子方程式说明)。
③你认为乙同学是怎样做到让品红溶液的颜色变得越来越浅的?
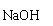
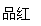
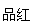
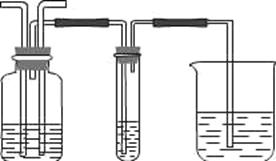
A B C D E
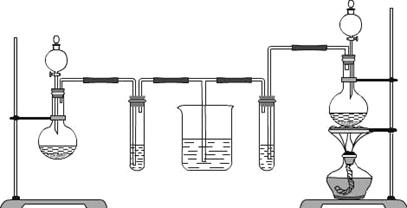
(1)实验室常用装置E制备Cl2,写出反应的离子方程式 。
(2)反应开始后,发现B.D两个试管中的品红溶液都褪去,停止通气后,给B.D两个试管加热,两个试管中的现象分别为B: ,D: 。
(3)装置C的作用是 。
(4)该实验小组的甲.乙两名同学利用上述两发生装置,按下图装置继续进行实验。
17.(10分)某化学实验小组同学为了证明和比较SO2和氯水的漂白性,设计了如下的实验装置。
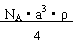 |
|||
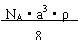 |
|||
C. D.
第Ⅱ卷(非选择题共52分)
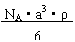 |
A.NA?a3?ρ B.
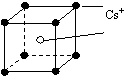 16.已知CsCl晶体的密度为ρg?cm-3, NA为阿伏伽德罗常数,相邻的两个Cs+的核间距为a cm,如图所示,则CsCl的相对分子质量可以表示为(
)
16.已知CsCl晶体的密度为ρg?cm-3, NA为阿伏伽德罗常数,相邻的两个Cs+的核间距为a cm,如图所示,则CsCl的相对分子质量可以表示为(
)
15.下列叙述正确的是( )
A.分子晶体中一定存在共价键
B.F2.Cl2.Br2.I2的熔沸点逐渐升高与分子间作用力有关
C.含有极性键的化合物分子一定不含非极性键
D.只要是离子化合物,其熔点一定比共价化合物的熔点高
+6.-2
+2
-2
下列叙述正确的是( )
A.R的氧化物对应的水化物可能具有两性
B.L.M的单质与稀硫酸反应的速率:M > L
C.T.Q的氢化物常态下均为无色气体
D.L.Q形成的简单离子核外电子数相等
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com