
10.下列各组离子:(1)K+、Fe2+、SO42-、ClO- (2)K+、Al3+、Cl-、HCO3-
(3)SO32-、SO42-、K+、OH- (4)Fe3+、Cu2+、SO42-、Cl-
(5)Na+、K+、AlO2-、HCO3- (6)Ca2+、Na+、SO42-、CO32-
|
A.(1)和(6) B.(3)和(4) C.(2)和(5) D.(1)和(4)
9.据报道,美国科学家在《Science》上发表论文,宣布发现了铝的“超级原子”结构-Al13和Al14。已知这类“超级原子”最外层电子数之和为40个时处于相对稳定状态。下列说法中,正确的是 ( )
A.Al13、Al14互为同位素
B.Al13超原子中Al原子间通过离子键结合
C.Al14最外层电子数之和为42,与第ⅡA族元素原子的性质相似
D.Al13和Al14都具有较强的还原性,容易失去电子生成阳离子
8.已知反应:①101kPa时,2C(s)+O2(g)=2CO(g);△H=-221kJ/mol。
②稀溶液中,H+(aq)+OH-(aq)=H2O(1);△H=-57.3kJ/mol
下列说法正确的是 ( )
A.碳的燃烧热大于110.5 kJ/mol
B.①的反应热为221 kJ/mol
C.浓硫酸与稀NaOH溶液反应的中和热为-57.3kJ/mol
D.稀醋酸与稀NaOH溶液反应生成1mol水,放出57.3kJ热量
7.在一定条件下,RO3-与R-发生如下反应: RO3-+5R-+6H+=3R2+3H2O;下列关于R元素的叙述,正确的是 ( )
A.R位于 VA族 B.R的氢化物的水溶液属于强酸
C.RO3-的R只能被还原 D.R2在常温常压下一定是气体
6.碱金属元素是周期性表现得最鲜明和最有规律的一族元素。下列说法正确的是 ( )
A.碱金属单质中锂的密度最小,熔点最低
B.碳酸钾溶液的pH<7
C.乙醇与金属钾反应生成氢气
D.用电解铯盐溶液的方法冶炼金属铯
5.已知在某温度时发生如下三个反应:
(1)C+CO2=2CO (2)C+H2O=CO+H2 (3)CO+H2O=CO2+H2
由此可以判断,在该温度下C、CO、H2的还原性强弱顺序是
A.C>CO>H2 B.CO>C>H2 C.C>H2>CO D.CO>H2>C
4.甲醇属于再生能源,可代替汽油作为汽车燃料。下列能正确表示甲醇燃烧热的热化学方程式为
A.CH3OH(l)+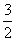 O2(g)=CO2(g)+2H2O(l);△H=+763.3kJ·mol-1
O2(g)=CO2(g)+2H2O(l);△H=+763.3kJ·mol-1
B.CH3OH(l)+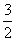 O2(g)=CO2(g)+2H2O(l);△H=-763.3kJ·mol-1
O2(g)=CO2(g)+2H2O(l);△H=-763.3kJ·mol-1
C.CH3OH(l)+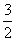 O2(g)=CO2(g)+2H2O(g);△H=-675.3kJ·mol-1
O2(g)=CO2(g)+2H2O(g);△H=-675.3kJ·mol-1
D.2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l);△H=-1526.6kJ·mol-1
3.下列各项叙述,不正确的是 ( )
A.液化石油气的主要成分是丁烷
B.乙醇和汽油都是可再生能源.应大力推广使用“乙醇汽油”
C.氮的固定是指将游离态氮转化为化合态氮的过程
D.光纤材料是以SiO2为主要原料制成的
2.下列叙述正确的是 ( )
A.直径介于1nm-100nm之间的微粒称为胶体
B.电泳现象可证明胶体属电解质溶液
C.利用丁达尔效应可以区别溶液与胶体
D.胶体粒子很小,可以透过半透膜
1.绿色化学提倡化工生产应提高原子利用率。原子利用率表示目标产物的质量与反应物总质量之比。原子利用率可以达到100%的化学反应是 ( )
A.取代反应 B.水解反应 C.加成反应 D.缩聚反应
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com