
5.发生严重水体镉污染事件时,一般采用加入聚合硫酸铁(PFS)(Fe2(OH)n(SO4)3-n/2)m,n<5,m<10,利用PFS在水体中形成絮状物来吸附镉离子。则下列说法中错误的是( )
A.核素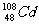 中子数为60 B.含镉废电池应进行集中回收处理
中子数为60 B.含镉废电池应进行集中回收处理
C.PFS中铁为+2价 D.由FeSO4制PFS需经过氧化、水解和聚合过程
4.C、N、S元素都是生命体的重要组成元素,它们在自然界的平衡已受到较大的破坏。C、N、S元素在地球大气圈、岩石圈、水系、生物圈的循环过程中会产生的物质是( )
①HNO3 ②CO2 ③糖类 ④CH4 ⑤SO2
A.② B.②③⑤ C.②③④ D.①②③④⑤
3.氕化锂、氘化锂、氚化锂可以作为长征2号火箭发射的重要燃料,下列说法正确的是 ( )
A.H、D、T之间互称同素异形体
B.氕化锂、氘化锂、氚化锂起催化剂作用
C.LiH、LiD、LiT的摩尔质量之比为1﹕2﹕3
D.它们都是强还原剂
2.美国科学家用有机分子和球形笼状分子C60,首次制成了“纳米车”(如图),每辆“纳米车”是用一个有机分子和4个球形笼状分子“组装”而成。 “纳米车”可以用来运输单个的有机分子,生产复杂的材料和药物,成为“纳米生产”中的有用工具。下列说法正确的是( )

A.我们可以直接用肉眼清晰地看到这种“纳米车”的运动
B.“纳米车”的诞生,说明人类操纵分子的技术进入一个新阶段
C.C60是一种新型化合物
D.C60熔点比金刚石熔点高
1.信息、材料、能源被称为新科技革命的“三大支柱”。下列有关资讯错误的是 ( )
A.在即将到来的新能源时代,核能、太阳能、氢能将成为主要能源
B.目前,中、美、日等国掌握的陶瓷发动机技术,能较大程度地降低能耗,节约能源
C.光缆在信息产业中有广泛应用,制造光缆的主要材料是单质硅
D.结构陶瓷碳化硼(B4C3)常用于制造切削工具,它是一种新型无机非金属材料,属于原子晶体
25.(11分)阿斯匹林(aspirin)的有效成分是乙酰水杨酸,它是19世纪末合成成功的,作为一个有效的解热止痛、治疗感冒的药物,至今仍广泛使用,有关报道表明,人们正在发现它的某些新功能。阿斯匹林是由水杨酸(邻羟基苯甲酸)与乙酸酐进行酯化反应而得的。
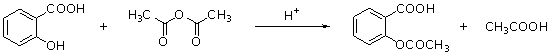
水杨酸 乙酸酐 乙酰水杨酸
(1)乙酰水杨酸的含氧官能团分别是_____________和酯基。
(2)乙酰水杨酸能在稀酸和NaOH溶液中水解。写出乙酰水杨酸与稀酸溶液共热的化学方程式:___________。
(3)写出同时符合下列四个要求的水杨酸的同分异构体: 。
①含有苯环;
②能发生银镜反应,不能发生水解反应;
③在稀NaOH溶液中,1 mol该同分异构体能与2 mol NaOH发生反应;
④只能生成两种一氯代产生。
(4)已知酚羟基遇FeC13溶液显紫色,但显色反应要在中性或弱酸性溶液进行。现要求用已有的知识检验出乙酰水杨酸分子中存在酯基。有人设计了如下的实验方案:
取一支洁净的试管,向其中加入2mL阿斯匹林清液,然后再滴入2 滴稀硫酸,将溶液在酒精灯上加热片刻后,滴入2滴FeC13溶液,振荡,无明显现象;再向其中逐滴加入Na2CO3溶液,振荡,出现了紫色。你认为逐滴加入Na2CO3溶液的目的是_____________。从此实验你得到的启示有_____________。
(5)为测定阿斯匹林中有效成分的含量,称取样品0.250 0 g ,准确加入浓度为0.1015 mol·L- NaOH溶液50.00 mL,煮沸60min。冷却后用浓度为0.1015 mol·L- 的HC1溶液返滴过量的NaOH,消耗HC1溶液记录如下:
|
数据 次数 |
1 |
2 |
3 |
|
初始读数 |
2.00 |
12.50 |
5.20 |
|
最后读数 |
27.10 |
37.40 |
33.20 |
则该产品中乙酰水杨酸的含量为(乙酰水杨酸的摩尔质量是180.16 g·mol- 。(只要求列式表示,不计算出最后结果)____________。
24.(9分)某研究性学习小组对过量炭粉与氧化铁反应的气体产物成分进行研究。
(1)提出假设:该反应的气体产物全部是二氧化碳。
(2)设计方案:如图所示,将一定量的氧化铁在隔绝空气的条件下与过量炭粉完全反应,测定参加反应的碳元素与氧元素的质量比。
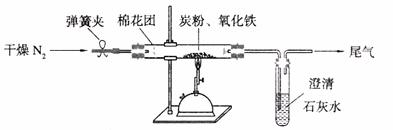
(3)查阅资料:氮气不与碳、氧化铁发生反应。实验室可以用氯化铵饱和溶液和亚硝酸钠(NaNO2)饱和溶液混合加热反应制得氮气。请写出该反应的离子方程式: 。
(4)实验操作及实验现象:
①按上图连接装置,并检查装置的气密性,称取3.20g氧化铁与2.00g炭粉混合均匀,放入48.48g的硬质玻璃管中;
②加热前,先通一段时间纯净干燥的氮气;
③停止通入N2后,夹紧弹簧夹,加热一段时间,澄清石灰水变浑浊;
④待反应结束,再通一段时间的氮气。冷却至室温,称得硬质玻璃管和固体总质量为52.24g。
(5)数据处理,经计算,参加反应的碳元素质量为0.48g氧元素为0.96g。得出原假设不成立,理由是 。
(6)得出结论:根据数据处理结果判断反应产生的气体是 ,该实验中发生的化学方程式为 。
(7)实验优化:根据实验得出的结论,应对该实验装置进一步完善,你认为应作如何改进 。
23.(10分)氧化还原反应中实际上包含氧化和还原两个过程。下面是一个还原过程的反应式:NO3-+4H++3e→NO+2H2O
KMnO4、Na2CO3、Cu2O、Fe2(SO4)3四种物质中的一种物质(甲)能使上述还原过程发生。
(1)写出并配平该氧化还原反应的方程式: 。
(2)反应中硝酸体现了 、 性质。
(3)反应中若产生0.2mol气体,则转移电子的物质的量是 mol。
(4)若1mol甲与某浓度硝酸反应时,被还原硝酸的物质的量增加,原因是: 。
22.(9分)下图是一些常见物质间的转化关系图,图中所有物质含有的元素中只有一种不是短周期元素,所有反应物、生成物及溶液中的水均未标出,乙反应②中还有3种产物未标出,X是室内装潢材料中产生的主要有害气体之一,G是由四种元素组成的强碱。
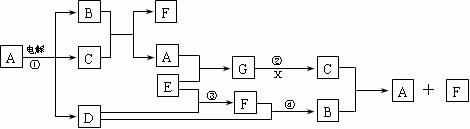
回答下列问题:
(1)写出下列物质的化学式:B 、C 、G ;
(2)列举两种能氧化X的物质(单质、化合物各一种) 、 ;
(3)写出反应①②的离子方程式: ① ;② 。
21.(6 分)某化学兴趣小组,专门研究了氧族元素及其某些化合物的部分性质。查得资料如下:①常温下,硒(Se)和碲(Te)为固体,H2Se和H2Te为气体;
②Te和H2不能直接化合生成H2Te
③氧气、硫、硒、碲与1mol H2反应热如下表所示。
|
物质 |
O2 |
S |
Se |
Te |
|
△H(kJ·mol-1) |
-242 |
-20 |
81 |
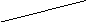 |
请回答下列问题:
(1)写出氧族元素中含有的18个电子的两种氢化物的化学式 、 。
(2)写出硒化氢发生反应的热化学方程式: 。
(3)一定温度下,在容积均为1L(容器容积不可变)的甲、乙两个容器中,分别充入2molSO2、 1molO2和4molSO2、2mol O2,在相同条件下使其反应。最终达到平衡后,甲、乙两容器中SO2转化率分别为50%和a(乙),则此时a(乙)________50%(填“大于”“小于”或“等于”)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com