
16.高铁电池是一种新型可充电电池,电解质溶液为KOH,放电时的总反应式为:( )
3Zn+2K2FeO4+8H2O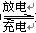 3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述正确的是
3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述正确的是
A.放电时负极反应为:3Zn -6e-+6OH- == 3Zn(OH)2
B.放电时OH-向正极移动
C.充电时每转移3 mol电子,阳极有1 mol Fe(OH)3 被还原
D.充电时阴极反应式为:3Zn(OH)2+6e- == 3Zn+6OH-
15.下列各组离子在碱性条件下能大量共存,而在强酸性条件下能发生氧化还原反应的是
( )
A.Ca2+、AlO2-、SO42-、Cl- B.K+、ClO-、Cl-、NO3-
C.Na+、K+、NO3-、SO32- D. NH4+、Na+、F-、CO32-
14.下列离子方程式书写正确的是 ( )
A.向CaCl2溶液中通入少量CO2气体: Ca2++CO2+H2O===CaCO3↓+2H+
B.碳酸氢钠溶液与硫酸氢钠溶液反应: HCO3-+H+=CO2↑+H2O
C.向苯酚钠溶液中通入少量CO2:
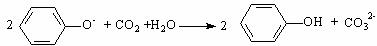
D.含有FeBr2溶液中通入足量的Cl2: 2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl-
13.下列各组变化中,化学反应的热量变化前者大于后者的一组是 ( )
①CH4 (g)+2O2 (g) = CO2 (g)+2H2O (1) ; ΔH1
CH4 (g)十2O2 (g) = CO2 (g)+2H2O (g) ;ΔH2
②2H2
(g)+O2(g) = 2H2O (1)
; ΔH1 ; H2 (g)+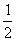 O2 (g) = H2O
(1) ; ΔH2
O2 (g) = H2O
(1) ; ΔH2
③t℃时,在一定条件下,将1mol SO2和1mol O2分别置于恒容和恒压的两个密闭容器中,达到平衡状态时放出的热量分别为Q1、Q2
④CaCO3(s)===CaO(s)+CO2(g) ; ΔH1 ; CaO(s)+H2O(l)===Ca(OH)2(s) ;ΔH2
A.①③ B.②③ C.①③④ D.①④
12.下列叙述正确的是 ( )
A.0.1mol·L-1氨水和氯化铵的混合液中,c(OH-)一定等于c(H+)
B.某温度下0.1mol•L-1的NaHB溶液中,c(Na+)= 0.1mol•L-1≥c(B2-)
C.在0.1 mol·L-1NH4Cl溶液中,c(H+)=c(NH3•H2O)+c(OH-)
D.0.1mol/L醋酸钡溶液中,c(Ba2+) >c(CH3COO-)>c(OH-)>c(H+)
11.阿伏加德罗常数约为6.02×1023mol-1,下列说法中错误的是 ( )
A.标准状况下,3.01×1023个CCl4所占的体积约为11.2 L
B.80 g NH4NO3晶体中约含有NH4+ 6.02×1023个
C.3.9 gNa2O2吸收足量的CO2时转移的电子数约是3.01×1022
D.46 g NO2和N2O4混合气体中含有原子数约为1.806×1024
9.在一定条件下发生下列变化,其中不属于盐类水解反应的是 ( )
A.HS-+H2O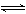 S2-+ H3O+ B.HCO3-+H2O
S2-+ H3O+ B.HCO3-+H2O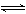 H2CO3+OH-
H2CO3+OH-
C.NH4++H2O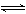 NH3·H2O+H+ D.AlO2-+2H2O
NH3·H2O+H+ D.AlO2-+2H2O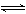 Al(OH)
3+OH-
Al(OH)
3+OH-
|
A.K2SO4·2Cr2(SO4)3 B.2K2SO4·Cr2(SO4)3
C.K2SO4·Cr2(SO4)3 D.K2SO4·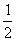 Cr2(SO4)3
Cr2(SO4)3
8.右图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容。据此下列说法正确的是 ( )

A.该试剂的物质的量浓度为9.2 mol·L-1
B.该硫酸50 mL与足量的铜反应可得到标准状况下SO2 10.3 L
C.配制200 mL 4.6 mol·L-1的稀硫酸需取该硫酸50 mL
D.该硫酸与等体积的水混合所得溶液的质量分数小于49%
7.有四组同族元素的物质,在101.3 kPa时测定它们的沸点(0C)如下表所示: ( )
|
第一组 |
He -268.8 |
(a) -249.5 |
Ar -185.8 |
Kr -151.7 |
|
第二组 |
F2 -187.0 |
Cl2 -33.6 |
(b) 58.7 |
I2
184.0 |
|
第三组 |
(c) 19.4 |
HCl -84.0 |
HBr -67.0 |
HI -35.3 |
|
第四组 |
H2O 100.0 |
H2S -60.2 |
(d) -42.0 |
H2Te -1.8 |
下列各项中正确的是 ( )
A.a、b、c的化学式分别为Ne2、Br2、HF
B.第二组物质只表现氧化性,不表现还原性
C.第三组物质对应水溶液均是强酸
D.第四组中各化合物的稳定性顺序为:H2O>H2S> H2Se>H2Te
6.下列实验操作中,正确的是 ( )
①用托盘天平称取5.2 g NaCl
②用50 mL 量筒量取5.2mL盐酸
③用蒸发皿加热NaCl溶液可以得到NaCl晶体
④用100 mL容量瓶配制50 mL 0.1mol•L-1 H2SO4溶液
⑤用带玻璃塞的棕色试剂瓶存放浓HNO3
⑥中和热测定的实验中使用的玻璃仪器只有2种
A.①③⑤ B.②④⑥ C.①③⑥ D.③④⑤
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com