
7.下列分离物质的方法正确的是: ( )
A.由于碘在酒精中的溶解度大,所以可用酒精将碘水中的碘萃取出来
B.水的沸点是100℃,酒精的沸点是78.5℃,可用直接加热蒸馏法使含水酒精变为无水酒精
C.可用冷却热的饱和氯化钾和氯化钠的溶液的方法得到纯净的氯化钠晶体
D.由于胶体微粒的粒度比离子大,所以碘化钾混入淀粉中可用渗析法分离
6.某化学小组用右图所示装置制取氯气.下列说法不正确的是 ( )
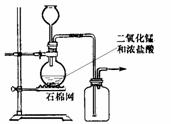
A.该装置图中至少存在三处明显错误

B.该实验中收集氯气的方法不正确
C.为了防止氯气污染空气,必须进行尾气处理
D.在集气瓶的导管口处放一片湿润的淀粉碘化钾试纸可以证明是否有氯气逸出
5.下列叙述不正确的是: ( )
A.常温下浓硫酸可贮存在铁制或铝制容器中,说明常温下铁和铝与浓硫酸不反应
B.将等物质的量的Cl2和SO2分别通入到品红溶液中,均能使品红溶液褪色
C.反应AgCl + NaBr  AgBr
+ NaCl能在水溶液中进行,是因为AgBr比AgCl更难溶于水
AgBr
+ NaCl能在水溶液中进行,是因为AgBr比AgCl更难溶于水
D.硝酸银溶液通常保存在棕色试剂瓶中,是因为硝酸银见光易分解
4.只给出下列甲和乙中对应的量,不能求出物质的量的是: ( )
|
|
A |
B |
C |
D |
|
甲 |
物质的粒子数 |
某条件下气体的摩尔体积 |
固体的体积 |
溶液的物质的量浓度 |
|
乙 |
阿伏加德罗常数 |
该条件下的气体体积 |
固体的密度 |
溶液的体积 |
3.某氯化镁溶液的密度为d g·cm─3,其中镁离子的质量分数为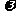 ,a mL该溶液中Cl─的物
,a mL该溶液中Cl─的物
质的量为: ( )
A.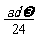 mol B.
mol B.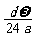 mol C.
mol C.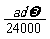 mol D.
mol D.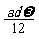 mol
mol
2.下列反应的离子方程式书写正确的是: ( )
A.硫酸镁溶液与氢氧化钡溶液反应:SO42─+Ba2+== BaSO4↓
B.澄清石灰水与碳酸氢钙溶液反应:Ca2++HCO3─+OH─== CaCO3↓+H2O
C.实验室用浓盐酸与MnO2反应制Cl2:MnO2+2H++2Cl─ Cl2↑+Mn2++H2O
Cl2↑+Mn2++H2O
D.氯气通入冷水中: Cl2+ H2O == ClO─+Cl─+2H+
1.下列说法正确的是: ( )
①正常雨水的pH为7.0,酸雨的pH小于7.0
②严格执行机动车尾气排放标准有利于防止大气污染
③使用二氧化硫和某些含硫化合物进行增白的食品对人体健康产生损害
④使用氯气对自来水消毒过程中,生成的有机氯化物可能对人体有害
⑤食品厂产生的含丰富氮、磷营养素的废水可长期排向水库养鱼
A.①②③ B.①④⑤ C.②③④ D.③④⑤
29.[物质结构与性质](10分)
图表法、图象法是常用的科学研究方法。
I.短周期某主族元素M的电离能情况如图(A)所示。则M元素位于周期表的第 族。
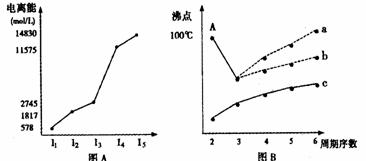
II.图B是研究部分元素的氢化物的沸点变化规律的图像,折线c可以表达出第 族元素氢化物的沸点的变化规律。不同同学对某主族元素氢化物的沸点的变化趋势画出了两条折线--折线a和折线b,你认为正确的是: ,理由是: 。
III.人类在使用金属的历史进程中,经历了铜、铁、铝之后,第四种将被广泛应用的金属则被科学家预测为是钛(Ti)。钛被誉为“未来世纪的金属”。试回答下列问题:
(1)22Ti元素基态原子的价电子层排布式为 。
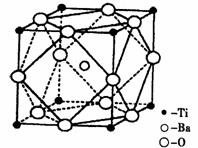
(2)在Ti的化合物中,可以呈现+2、+3、+4三种化合价,其中以+4价的Ti最为稳定。偏钛酸钡的热稳定性好,介电常数高,在小型变压器、话筒和扩音器中都有应用。偏钛酸钡晶体中晶胞的结构示意图如下图,则它的化学式是 。
28.[有机化学基础](10分)
2006年5月15日国家食品药品监督管理局通报了齐齐哈尔第二制药有限公司假药案的情况。“齐二药”违反规定,购入工业用“二甘醇”(化学式为C4H10O3)代替医用丙二醇(化学式为C3H8O3)作辅料,用于“亮菌甲素”注射液的生产,导致病人肾功能急性衰竭,造成多人死亡。二甘醇又称乙二醇醚,分子式C4H10O3 (HO-CH2-CH2-O-CH2-CH2-OH)。以二甘醇为原料,可制取醚、酸、酯、胺等多种化工产品,其主要产品有吗啉及其衍生物1,4-二恶烷(1,4-二氧环已烯),二甘醇单(双)醚,二甘醇酯类(饱和酯和不饱和酯)等,被广泛应用于石油化工、橡胶、塑料、纺织、涂料、粘合剂、制药等行业,用途十分广泛。二甘醇一般的合成路线为:
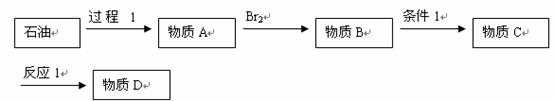
请回答下列问题:
⑴过程1是石油加工中常用步骤,其名称为 。
⑵从物质B到物质C的过程如果条件控制不好会生成另一种物质E,E可用于金属的气割和氧气焊,则为了能得到二甘醇D,物质B到物质C的反应条件是 ;该反应属于 (填有机反应类型)。
⑶物质D就是二甘醇,则合成路线中的物质A、B、C的结构简式分别为:
A: ,B: ,
C: 。
⑷反应1的化学方程式为: 。
27. CO不仅是家用煤气的主要成分,也是重要的化工原料。美国近年来报导了一种低温低压催化工艺,把某些简单的有机物经“羰化”反应后可以最后产生一类具有优良性能的装饰性高分子涂料、粘合剂等。如下图所示:
CO不仅是家用煤气的主要成分,也是重要的化工原料。美国近年来报导了一种低温低压催化工艺,把某些简单的有机物经“羰化”反应后可以最后产生一类具有优良性能的装饰性高分子涂料、粘合剂等。如下图所示:
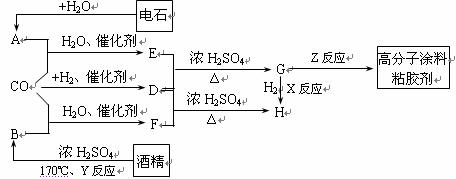
图中G(RCOOR,)的一种同分异构体是E的相邻同系物;而H的一种同分异构体则是F的相邻同系物。已知D由CO和H2按物质的量之比为1∶2完全反应而成,其氧化产物可发生银镜反应;H是含有4个碳原子的化合物。试写出:
(1)结构简式:E 、G 、R,基 。
(2)G的两个同类别同分异构体的结构简式(不带R字母)
及 。
(3)反应类型:X 、Y 、Z 。
(4)写出下列转化的化学方程式:
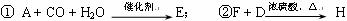
① ;
② 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com