
25.能源是人类社会发展进步的物质基础,在当代,能源、信息、材料一起构成了现代文明的三大支柱。为了缓解能源危机和减少汽油燃烧所产生的污染,目前已普遍推广使用新型车用燃烧--乙醇汽油。乙醇汽油是将乙醇和普通汽油按一定体积比混合而成的,已知某乙醇汽油蒸气中乙醇和汽油的体积比约为1:4。请回答下列问题:
(1)若以辛烷代表汽油的成分,请写出乙醇汽油燃烧的化学方程式:
。
(2)若以辛烷代表汽油的成分,并设空气中氧气所占的体积分数为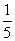 ,则相同条件下,相同体积汽油、乙醇汽油分别在气缸内完全燃烧时,所消耗空气的体积比是 。
,则相同条件下,相同体积汽油、乙醇汽油分别在气缸内完全燃烧时,所消耗空气的体积比是 。
(3)若用乙醇汽油设计燃料电池,在一个电极通入空气,另一个电极通入乙醇汽油蒸气,电解质是掺杂了Y2O3的ZrO2晶体,它在高温下能传导O2-,则该电极正极发生的电极反应是 。
(4)据最新报道,巴西新一代乙醇燃料汽车总量已突破200万辆,为了更好推广乙醇燃料汽车的使用,巴西政府决定向普通汽车购买者征收16%的消费税,而只向乙醇燃料汽车购买者征收14%的消费税。巴西地处南美洲,是世界上甘蔗产量巨大的国家之一,乙醇是从甘蔗中提炼中加工出来的。请写出由甘蔗渣制备乙醇的化学反应方程式: 。
24.在如图所示的装置中,由A处通入气体,试剂瓶中的现象为溶液先变浑浊,后又变澄清。

(1)若试剂瓶中的溶液为碱,则通入的气体为 或 。
(2)若试剂瓶中的溶液是显碱性的盐溶液,则通入的气体为 。离子方程式为 。
(3)若反应结束后,试剂瓶中的溶液中加入葡萄糖溶液,再水浴加热,
生成银镜,则原试剂瓶中的溶液为 ,通
入的气体为 .
(4)在试剂瓶中加入BaCl2溶液,在A处先通入一种气体,无沉淀产生;
若继续通入另一种气体,则有白色沉淀产生,且B处有气体放出,
放出的气体遇到空气马上变为红棕色,则气体A为 ;
生成的沉淀为 。
23.下表中的实线表示元素周期表的部分过界。①~⑤分别表示元素周期表中对应位置的元素。

(1)元素③在周期表中的位置是 周期 族。
(2)元素③④⑤氢化物的稳定性由强到弱的顺序是 (用氢化物的化学式表示)。
(3)请在上表中用实线补全元素周期表边界。
(4)甲、乙两种化合物均由①②③④四种元素组成,写出此两种化合物在水溶液中发生反应的离子方程式 。
(5)X、Y、Z、W代表原子序数依次增大的四种短周期元素。在周期表中,Y与X相邻,Y与Z也相邻;X、Y和Z三种元素原子的最外层电子数之和为17;元素W与②形成离子化合物丙,物质丙的电子式为 ,写出实验室制W2的化学方程式,并标出电子转移的方向和数目: 。
X单质和①单质在一定条件下可生成化合物E(分子中有10个电子),分子的结构呈 ,晶体类型为 。
22.(7分)硝酸发生氧化还原反应的时候,一般硝酸浓度越稀,对应还原产物中氮的化合物越低,可依次有NO2、NO、N2O、N2、NH4NO3。
现有一定量的铝粉和铁粉的混合物与一定量很稀的HNO3充分反应,反应过程中无任何气体放出。在反应结束后的溶液中,逐滴加入4mol·L-1NaOH溶液。所加NaOH溶液的体积(mL)与产生沉淀的物质的量(mol)关系如下图所示:
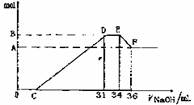
(1)和铝粉和铁粉的混合物反应时,HNO3对应还原产物为 (填化学式)。
(2)完成下列过程中的离子反应方程式:
O→C
D→E
E→F
(3)B值是多少mol?写出计算过程。
21.(10分)
 I.接触法制硫酸的某阶段的反应为:2SO2+O2 2SO3;△H =-196.6kJ/mol该反应在
I.接触法制硫酸的某阶段的反应为:2SO2+O2 2SO3;△H =-196.6kJ/mol该反应在
(填一种设备)中进行,这种设备中部装有一个热交换器,其作用是
。
II.电解原理在化学工业中有广泛应用。下图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。请回答下以问题:
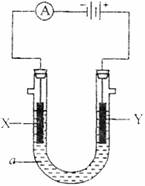
(1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则
①电解沁中X极上的电极反应式为 。在X极附近观察到的现象是 。
②Y电极上的电极反应式为 ,检验该电极反应产物的方法是 。
(2)如果要用电解方法精炼粗铜,电解液a选用CuSO4溶液,则
①X电极的材料是 ,电极反应式是 。
②Y电极的材料是 ,电极反应是 。
(说明:杂质发生的电极反应不必写出)
20.(10分)根据硫酸铜晶体结晶水含量的测定实验:填写下列空白
此实验操作顺序如下:①称量坩埚、晶体;②加热、冷却;③称量;④再加热、冷却;⑤称量;⑥计算;⑦分析实验误差。
(1)用托盘天平称量的时候,若指针偏向左边,则表示(填写正确的选项代码) 。
A.左盘重,样品轻 B.左盘轻,砝码重
C.右盘重,砝码轻 D.右盘轻,样品重
(2)在进行加热时,应该用 来夹持坩埚;为了防止硫酸铜晶体失去结晶水时不完全,或发生CuSO4强热分解,造成实验产生误差,所以在加热操作中要①
② 。
(3)加热后的坩埚应放在 中冷却。如果放在空气中自然冷却,则会使实验结果的误差偏 。
(4)在进行④、⑤两步实验中,有时还要重复进行,这是由于 。
(5)在硫酸铜晶体结晶水含量的测定实验中,若坩埚的质量为m,坩埚与硫酸铜晶体的质量为m1,加热后称量坩埚与无水硫酸铜的质量为m2,则晶体中结晶水的质量分数ω= (写计算式)。如果实验中加热温度过高,固体颜色变黑,则测定结果会 (填“不变”、“偏高”、“偏低”)。
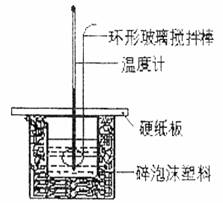
19.(5分)实验室用50ml 0.50mol·L-1盐酸、50ml 0.55mol·L-1NaOH溶液和下图所示装置进行测定中和热的实验,得到表中的数据:
|
实验次数 |
起始温度t1/℃ |
终止温度 |
|
|
|
盐酸 |
NaOH溶液 |
|
|
1 |
20.2 |
20.3 |
23.7 |
|
2 |
20.3 |
20.5 |
23.8 |
|
3 |
21.5 |
21.6 |
24.9 |
回答下列问题:
(1)实验时用环形玻璃搅拌棒搅拌溶液的方法是
不能用铜丝搅拌棒代替玻璃棒的理由是 。
(2)经数据处理,t2-t1=3.4℃,则该实验测得的中和热△H = 。[盐酸和NaOH溶液的密度按1g/cm3计算,反应后混合溶液的比热容(C)按4.18J/(g·℃)计算]。
(3)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得中和热为△H1,则△H1与△H的关系为:△H1 △H(填“<”“>”或“=”)
18.为提纯下列物质(括号内为少量杂质),所选用的除杂试剂与主要分离方法都正确的是
( )
|
|
不纯物质 |
除杂试剂 |
分离方法 |
|
A |
苯(甲苯) |
KMnO4(酸性),NaOH溶液 |
分液 |
|
B |
NH4Cl溶液(FeCl3) |
NaOH溶液 |
过滤 |
|
C |
乙酸乙酯(乙酸) |
KOH溶液,水 |
分液 |
|
D |
苯(苯酸) |
浓Br2水 |
过滤 |
|
17.某研究性学习小组在老师指导下做了一个如图所示的实验,发现烧杯中酸性KMnO4溶液褪色。若将烧杯中的溶液换成含有少量KSCN的FeCl2溶液,溶液显红色。判断下列说法中正确的是 ( )
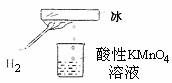
A.该条件下生成的水分子化学性质比较活泼
B.该条件下H2被冷却为液态氢,液氢的水溶液具有还原性
C.该条件下H2燃烧生成了具有还原性的物质
D.该条件下H2燃烧的产物中可能含有一定量的H2O
16.新鲜水果、蔬菜、乳制品中富含的维生素C具有明显的抗衰老作用,但易被空气氧化。某课外小组利用碘滴定法测某橙汁中维生素C的含量,其化学方程式为:
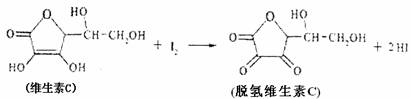
下列说法正确的是 ( )
A.上述反应为取代反应 B.滴定时可用淀粉溶液作指示剂
C.滴定时应剧烈振荡锥形瓶 D.脱氧维生素C的分子式为C6H8O6
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com